01/09/2022 (2022-09-01)
[Source : France Soir]
Le 16 août dernier, le gouvernement britannique a recommandé aux femmes enceintes et allaitantes de ne pas recevoir le vaccin contre le Covid-19, admettant que « des garanties suffisantes quant à l’utilisation sûre du vaccin ne peuvent être fournies à l’heure actuelle ».
Que dit le rapport anglais ?
Les conclusions du gouvernement britannique ont été révélées dans un rapport détaillé du ministère de la Santé et des Affaires sociales du pays, intitulé « Summary of the Public Assessment Report for COVID-19 Vaccine Pfizer/BioNTech« , mis à jour le 16 août. Le document a été publié par l’Agence de réglementation des médicaments et des produits de santé du gouvernement.
La section « Conclusions sur la toxicité » du rapport explique pourquoi le ministère recommande de ne pas administrer le vaccin aux femmes enceintes et allaitantes :
« Dans le contexte de l’approvisionnement en vertu du règlement 174, on considère qu’il n’est pas possible, à l’heure actuelle, de fournir des garanties suffisantes quant à la sécurité d’utilisation du vaccin chez les femmes enceintes : toutefois, l’utilisation chez les femmes en âge de procréer pourrait être soutenue à condition que les professionnels de la santé soient invités à exclure toute grossesse connue ou suspectée avant la vaccination. Les femmes qui allaitent ne devraient pas non plus être vaccinées. Ces jugements reflètent l’absence de données à l’heure actuelle et ne reflètent pas un constat spécifique préoccupant. Des conseils adéquats concernant les femmes en âge de procréer, les femmes enceintes et les femmes qui allaitent ont été fournis à la fois dans les informations destinées aux professionnels de santé britanniques et dans les informations réservées aux destinataires. […] L’absence de données sur la toxicité pour la reproduction reflète la rapidité du développement pour identifier et sélectionner le vaccin à ARNm COVID-19 BNT162b2 pour les tests cliniques et son développement rapide pour répondre à un besoin sanitaire urgent. En principe, une décision sur l’homologation d’un vaccin pourrait être prise dans ces circonstances sans données provenant d’études de toxicité pour la reproduction chez les animaux, mais des études sont en cours et elles seront fournies lorsqu’elles seront disponibles ».
L’absence de données cliniques pour la reproduction
Cependant, les raisons invoquées dans le rapport sur l’absence des données cliniques sont loin d’être la seule cause. En effet, il faut rappeler que la décision de vacciner les femmes enceintes contre le Sars-CoV-2 et le discours sur l’absence de dangerosité qui accompagnait la campagne vaccinale, a été l’une des mesures les plus surprenantes, puisqu’il n’existait aucune donnée associée à l’utilisation de ces nouvelles thérapies géniques pendant la grossesse et l’allaitement. Cette absence de données clinique s’explique par le seul fait qu’il s’agit d’une population protégée par les lois de protections des patients et que les femmes enceintes sont d’office sorties des essais cliniques.
Il faut également rappeler que dans son Plan de Gestion des Risques, Pfizer ne s’est pas caché qu’il existait des données manquantes pour certaines catégories de personnes et que le profil de tolérance des vaccins est non connu chez les femmes enceintes ou allaitantes du fait de leurs exclusions de l’étude de phase 3.
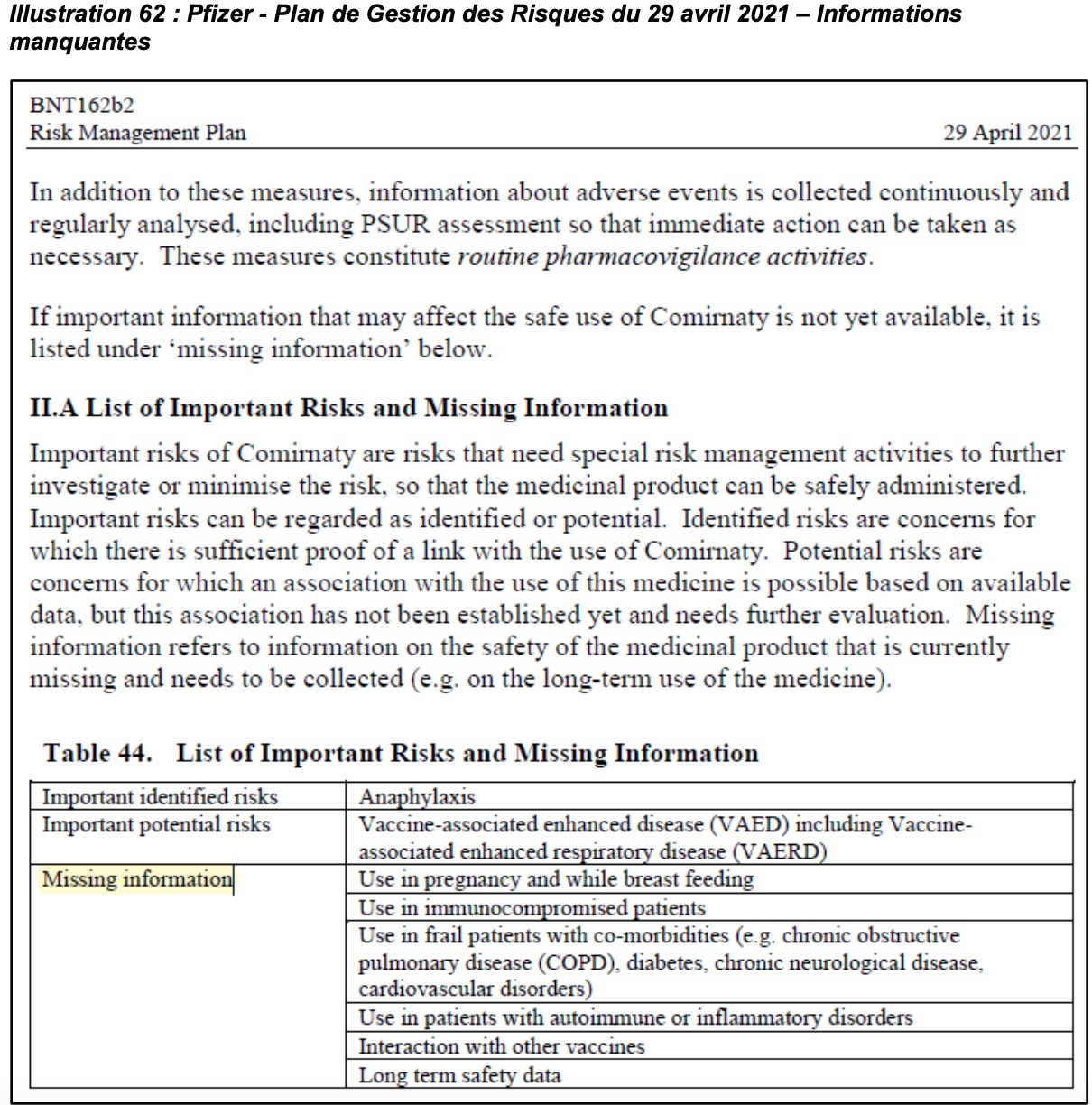
Pourtant, des cas d’effets indésirables ont été rapportés dans le premier rapport de la FDA sur la première déclassification des données de Pfizer. Bien que les femmes enceintes aient été exclues des essais cliniques, elles ont, elles aussi, fait l’objet de vaccinations en vie réelle, et le rapport fait état d’effets indésirables pour 270 grossesses rapportés comme suit : avortement spontané (23), résultat en attente (5), naissance prématurée avec décès néonatal, avortement spontané avec décès intra-utérin (2 chacun), avortement spontané avec décès néonatal et résultat normal (1 chacun).
On ne sait pas si depuis ces événements, le lien de causalité a été établi. Cependant, on peut néanmoins s’étonner de trouver des femmes enceintes vaccinées à cette époque. Il est vrai que la FDA avait donné l’autorisation pour toutes les personnes de plus de 16 ans et que les personnes à risque ont été vaccinées en priorité, ce qui sous-entendait les femmes enceintes.
Si elles ont été exclues des essais initiaux de Pfizer et Moderna pour les raisons évoquées ci-dessus, l’étude du 17 juin 2021 remaniée et publiée le 8 septembre 2021 dans le New England Journal of Medecine révèle que les cliniciens se seraient appuyés sur les données de Moderna sur le développement et la reproduction chez l’animal, qui n’ont montré aucun problème de sécurité. Les résultats sur les animaux sont-ils toujours transférables à l’homme ? Non, c’est d’ailleurs la raison pour laquelle, lorsque les résultats sur les animaux démontrent que le risque est faible, la substance peut être étudiée également chez l’homme, dans les essais cliniques. Par conséquent, en l’absence de données de sécurité chez l’homme, et malgré les risques que le Covid représente pour les femmes enceintes, il est étonnant de lire dans cette même étude qu’il « n’y a aucune raison biologique plausible pour que la technologie ARNm soit nocive pendant la grossesse ». En effet, on est en droit de se demander sur quelle base scientifique les chercheurs se sont appuyés pour écrire cela alors que tant de médicaments connus et approuvés depuis longtemps sont interdits ou déconseillés pendant la gestation.
La même interrogation subsiste pour les médecins, les cliniciens lorsque certains d’entre eux ont conseillé le vaccin aux femmes enceintes. Comment ont-ils pu mettre en balance les risques documentés d’infection par le Covid-19 et les risques de sécurité inconnus de la vaccination, et ce, afin « d’éclairer » leurs patientes ?
Si dans la première étude parue dans le New England Journal of Medecine, les auteurs affirmaient qu’il n’y avait pas lieu de s’alerter sur la vaccination des femmes enceintes et que le vaccin ARN messager était sûr, ils étaient par la suite revenus sur certaines des affirmations contenues dans l’étude initiale pour apporter quelques corrections dans l’étude remaniée.
Cette seconde étude se concluait sur la nécessité d’inclure les femmes enceintes dans les essais cliniques. Une remarque qui arrivait cependant, tardivement, alors qu’il existait déjà à cette époque de forts soupçons d’événements indésirables graves sur lesquels il aurait fallu faire toute la lumière pour établir si oui ou non, il existe un lien de causalité avec la vaccination.
Encore aujourd’hui, beaucoup d’inconnues subsistent, et ce, pour la simple raison qu’il n’y a à ce jour aucun résultat d’essai clinique sur les femmes enceintes ou allaitantes terminé, comme l’explique la biostatisticienne Christine Cotton.
Fallait-il réaliser des essais cliniques sur les femmes enceintes avant le début de la vaccination en population générale ? Le débat est difficile à trancher. Les tests peuvent mettre en danger la santé du fœtus, mais le déficit d’information peut aussi être dommageable pour la mère et l’enfant. Et, commencer des essais cliniques plusieurs mois après avoir commencé à vacciner en population générale paraît dénué de toute logique.
⚠ Les points de vue exprimés dans l’article ne sont pas nécessairement partagés par les (autres) auteurs et contributeurs du site Nouveau Monde.




















