03/06/2024 (2024-06-03)
Capsule d’information concernant les infrasons qu’émettent les éoliennes, avec le Dr Mariana Alves-Pereira, professeur associé à l’Université Lusofona à Lisbonne au Portugal. Dr Pereira a un baccalauréat en physique et une maîtrise en génie biomédical ; elle a obtenu son doctorat en sciences environnementales.
Altération de l’endothélium et troubles de la microcirculation chez les humains et les animaux exposés aux infrasons en raison d’une mécanotransduction irrégulière
Journal of Biosciences and Medicines, 2023, 11, 30-56
https://www.scirp.org/journal/jbm
ISSN en ligne : 2327-509X
ISSN imprimé : 2327-5081
Par Ursula Maria Bellut-Staeck
Scientifique indépendante, Berlin, Allemagne
Comment citer cet article : Bellut-Staeck,
U.M. (2023) Impairment of the Endothelium and Disorder of Microcirculation in Humans and Animals Exposed to Infrasound due to Irregular Mechano-Transduction. Journal of Biosciences and Medicines, 11, 30-56.
https://doi.org/10.4236/jbm.2023.116003
Reçu : 24 avril 2023
Accepté : 10 juin 2023
Publié : 13 juin 2023
Copyright © 2023 par les auteurs et Scientific Research Publishing Inc.
Ce travail est placé sous la licence Creative Commons Attribution International
Licence (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/
Résumé
La microcirculation des mammifères est un système synchronisé complexe et autorégulé en fonction de la demande actuelle en nutriments et en oxygène. Le bon déroulement des fonctions vitales telles que la croissance, la régulation de la pression sanguine, la séquence inflammatoire et l’embryogenèse est lié à l’intégrité de l’endothélium. La vasomotion sensible en est particulièrement dépendante. Les réseaux de signalisation par mécano-transduction jouent un rôle essentiel dans les processus cellulaires vitaux et constituent le mécanisme physiologique décisif pour une libération adéquate de NO, principal responsable de l’autorégulation des vaisseaux. Une perturbation de l’intégrité endothéliale, provenant par exemple d’un stress oxydatif chronique et/ou d’un stress mécanique (oscillatoire), entraîne une perturbation de la vasomotion ainsi qu’un déséquilibre des systèmes d’oxydoréduction, reconnu comme la cause principale du développement de maladies inflammatoires chroniques telles que l’athérosclérose et des maladies secondaires correspondantes, éventuellement le cancer. Le cytosquelette endothélial, qui correspond à un « modèle de tenségrité » viscoélastique, offre la possibilité d’une mécanotransduction grâce à sa construction spéciale. L’augmentation rapide des connaissances sur les forces mécaniques dans la détection et la régulation cellulaires au cours des dernières années (qui a culminé avec le prix Nobel pour le décodage des canaux ioniques détectant la pression/vibration) nous a conduits à l’hypothèse suivante : le facteur de stress externe « bruit » produit dans certaines conditions un champ de stress oscillatoire dans le lit d’écoulement physiologiquement laminaire des capillaires, qui peut conduire à des mécano-transductions irrégulières. Les résultats indiquent une dépendance stricte de la fréquence dans la mécano-transduction avec la détermination de seuils pour une transmission 1:1. Les connaissances récemment acquises sur la mécano-transduction endothéliale jettent un nouvel éclairage sur l’importance des basses fréquences. Cela pourrait indiquer la manière physiopathologique longtemps recherchée par laquelle les infrasons peuvent exercer un effet de stress au niveau cellulaire. Les citoyens exposés au bruit, qui vivent à proximité d’infrastructures telles qu’une installation de biogaz, des pompes à chaleur, des centrales thermiques de type bloc et de grandes éoliennes industrielles (IWT), présentent dans le monde entier une symptomatologie associée à des troubles de la microcirculation. Des effets sur les insectes ou les poissons sont également concevables, puisque les canaux piézo-électriques sont reconnus comme des structures conservées de tous les organismes multicellulaires. Un plan expérimental est proposé pour démontrer l’influence pathologique directe d’infrasons de force, de fréquence, de profil d’effet/temps et de durée définis sur la vasomotion sensible.
Mots clés
Mécano-transduction, Cytosquelette endothélial, Infrasons, Stress oscillatoire, Vasomotion
1. Introduction
1.1. Structure, composants et régulation du système de microcirculation chez les mammifères
Les cellules endothéliales plates tapissent tous les vaisseaux du mammifère (y compris les vaisseaux lymphatiques), qui est son plus grand organe. Responsables de l’ensemble du transport du métabolisme de l’énergie et des substrats ainsi que de nombreuses fonctions vitales, elles ont une très grande surface (environ six terrains de football chez l’adulte) [1]. La cellule endothéliale correspond dans sa structure à une cellule somatique et est spécifiée pour ses diverses tâches, le vaisseau respectif (vaisseau capillaire, artère) ainsi que le type de tissu (zone splanchnique, rein, cerveau) étant responsables de sa spécification ultérieure [2]. Elle diffère par sa forme, son expression et sa surface, ainsi que par sa dotation en récepteurs du système adrénergique. Selon leur ultrastructure, les cellules endothéliales se différencient, en fonction de leur sous-structure spécifique à l’organe, en différents types d’endothélium continu, fenêtré et discontinu. Le système circulatoire est constitué d’une combinaison de vaisseaux, connectés en série et en parallèle, dans lesquels, conformément à la loi d’Ohm, la résistance totale diminue avec chaque connexion parallèle supplémentaire [2]. En régulant la résistance via les artérioles en amont, nous trouvons physiologiquement des flux laminaires avec une vitesse uniforme, strictement liée à la taille du vaisseau, dans le réseau capillaire. Il s’agit d’une condition préalable essentielle aux diverses tâches vitales de la microcirculation [2] [3]. En revanche, nous constatons un stress oscillatoire chronique, un facteur causal important de l’athérosclérose, au niveau des branches vasculaires et des courbes les plus fortes des vaisseaux de taille moyenne et de grande taille. L’une des principales tâches de la microcirculation est d’adapter le flux sanguin vasculaire aux besoins actuels [1] [4]. La densité fonctionnelle des vaisseaux (DFP) dans le muscle au repos est d’environ 25 % de la densité totale des vaisseaux (DTV). Inversement, cela signifie également que le débit sanguin peut être augmenté d’un multiple [5]. La capacité de compensation du réseau capillaire est donc plusieurs fois supérieure à celle de la « macrocirculation ». Sous l’effet d’une contrainte physique, ce que l’on appelle le recrutement capillaire, selon Moore et Fraser 2015 [6], commence par abaisser la résistance vasculaire des artérioles en amont, ce qui entraîne une augmentation significative de la surface d’échange des nutriments et une diminution de la distance entre deux capillaires avec, par conséquent, une distance de diffusion réduite pour l’oxygène et les nutriments. La régulation du flux sanguin local (appelée fonction vasomotrice) est extrêmement complexe et « orchestrée » [4]. Elle est contrôlée par des facteurs intrinsèques et extrinsèques (par exemple, le système nerveux autonome et les hormones vasoactives, telles que l’adrénaline, la vasopressine, l’angiotensine et la sérotonine) qui modulent l’activité intrinsèque [1], en fonction également de la taille des vaisseaux et de la distribution des récepteurs adrénergiques dans un organe donné.
L’une des bases de la régulation intrinsèque est constituée par l’effet Bayliss [7]. Le débit sanguin est maintenu constant : si le débit sanguin augmente, il y a vasoconstriction, si le débit sanguin diminue, il y a vasodilatation. Une deuxième base est constituée par les facteurs métaboliques selon la théorie classique, dans laquelle l’hypoxie locale entraîne une libération accrue de substances actives vasodilatatrices (par exemple, NO, ATP, prostaglandines), ce qui provoque une augmentation du flux sanguin local. L’accumulation de métabolites tels que le lactate, les ions hydrogène, le potassium et l’adénosine maintient cet effet [1]. L’une des conditions préalables les plus importantes et les plus responsables de la biodisponibilité du NO est la réponse classique à la contrainte de cisaillement laminaire due aux forces mécaniques, selon Chien 2007 [8]. Le NO est déclenché de manière classique par le flux sanguin qui provoque un changement mécanique au niveau de la membrane des cellules endothéliales et est formé à partir de son précurseur, la L-arginine, par l’intermédiaire de la NO-synthétase (NOS). Le NO est un médiateur de la relaxation vasculaire par l’activation de la guanylyl cyclase soluble (sGC) qui catalyse la conversion de la guanosine triphosphate (GTP) en 3′-5′-guanosine monophosphate cyclique (GMPc).
Ce dernier est extraordinairement typique de la microcirculation, mais c’est l’un des phénomènes les moins bien expliqués : la vasomotion.
La vasomotion a été observée pour la première fois dans l’exemple classique d’une veine de chauve-souris et décrite comme une contractilité rythmique qui accélère le flux sanguin vers l’avant grâce à des pulsations fines et synchronisées [9]. Les causes et le contrôle de ce phénomène n’ont pas encore été entièrement élucidés. Selon l’état actuel des connaissances, la vasomotion dépend de l’intégrité de l’endothélium et sert apparemment à optimiser l’apport en nutriments [10]. La vasomotion peut être directement observée in vivo en microscopie vidéo SDF. Citation de Aalkjaer C. Mulvany MJ 2020) [10] au cap. 1.3 page 7 :
« Peut-être que la seule caractéristique liée à la vasomotion sur laquelle tout le monde s’accorde est qu’une oscillation du potentiel de membrane des cellules musculaires lisses est à l’origine de l’oscillation du tonus individuel des cellules musculaires lisses et de la synchronisation des cellules musculaires lisses […]. Cela suggère fortement que le [Ca2+] dans les cellules musculaires lisses oscille également de manière synchronisée — et c’est effectivement le cas. […]».
L’article original [10] contient des informations plus approfondies.
L’étendue de l’implication endothéliale dans les syndromes cliniques est immense, tout comme le sont les facteurs potentiels qui peuvent influencer la microcirculation de manière positive ou négative. Les influences potentielles les plus importantes proviennent de fonctions vitales telles que l’apport d’oxygène et de nutriments, la croissance, l’embryogenèse, la coagulation sanguine, la régulation immunitaire, etc. Les principales causes de dysfonctionnement sont celles qui peuvent perturber l’intégrité de l’endothélium, en particulier un excès de stress oxydatif et oscillatoire.
1.2. Homéostasie du système redox
La libération adéquate de NO, avec la bonne quantité, au bon endroit et au bon moment, est cruciale pour la régulation synchronisée du flux sanguin et le maintien de la santé vasculaire [11]. En tant qu’antioxydant puissant, il joue un rôle décisif dans l’homéostasie de l’ensemble du métabolisme redox avec l’interruption de la peroxydation des lipides et donc la diminution des radicaux libres d’oxygène (ROS) agressifs ([11] [12] Tableau 1). En tant que radical libre (à l’état gazeux), il peut se diffuser librement à travers les membranes. Les effets vasculaires du NO sont présentés comme protecteurs, régulateurs ou délétères [11] [13]. La façon dont la réaction se déroule réellement dépend, selon Laurindo F. et al [11], de plusieurs facteurs. Selon ces auteurs, les propriétés défavorables sont généralement associées à une production excessive de NO, les effets protecteurs du NO sont attribués à une production régulière et adéquate de NO dans une situation spécifique. Non seulement le NO, mais aussi ses trois isoenzymes de la NO-Synthétase endothéliale sont impliqués dans les voies de signalisation redox. En fonction du type d’isoenzyme et des conditions environnantes, elles ont également des effets protecteurs ou délétères, comme le montre le tableau 1.
Par conséquent, la dépendance d’un approvisionnement adéquat en NO aux forces physiques conduit à une sensibilité aux facteurs de stress externes qui pourraient conduire à une mécano-transduction irrégulière, conduisant éventuellement à un approvisionnement en NO accru et inadéquat. Pour plus de détails sur ce thème, voir les articles [11] [12] [13] [14].
Tableau 1. Les différents effets possibles de l’oxyde nitrique : protecteur, régulateur et délétère :
| Effets protecteurs : | Effets régulateurs : | Effets délétères : |
|---|---|---|
| – Antioxydant – Inhibe l’adhésion des leucocytes et des plaquettes – Protège contre la toxicité et la peroxydation | – Tonus vasculaire – Adhésion cellulaire – Perméabilité vasculaire – Neurotransmission – Bronchodilatation – Régulation de l’inflammation – Régulation de la fonction rénale | – Inhibe la fonction enzymatique – Induit des dommages à l’ADN – Induit la peroxydation des lipides – Augmente la sensibilité aux radiations, aux substances alkylantes et aux métaux toxiques – L’épuisement des réserves d’antioxydants |
Dans le domaine de la microcirculation, d’autres substances vasodilatatrices jouent un rôle décisif. Les segments vasculaires des artérioles réagissent aux auto-acides endothéliaux tels que l’angiotensine, la sérotonine, les eicosanoïdes [2] et aux agonistes tels que l’acétylcholine, la bradykinine ou la substance P, ainsi qu’aux variations de pression transmurale. Ils ne le font pas en tant qu’entités isolées, mais de manière coordonnée. Ce phénomène est attribué au facteur d’hyperpolarisation dérivé de l’endothélium (EDHF) [11]. L’EDHF a un effet à longue distance, car sa formation déclenchée localement peut également déclencher une réponse vasculaire rectifiée en amont et en aval. L’activation de l’écoulement de potassium dépendante du calcium par l’EDHF est suivie d’une hyperpolarisation avec transmission du transfert d’électrons à l’intérieur de la paroi vasculaire via les jonctions lacunaires et sans perte de temps [15]. La réaction de transmission est comparable à un banc de poissons, très rapide et synchronisé [5]. Les possibilités de la stimulation microtactile par rapport au déclenchement par l’acétylcholine ont été testées et confirmées expérimentalement [5].
1.3. Homéostasie de l’inflammation et de la fibrose
Toutes les séries de réactions séquentielles dépendent de l’intégrité de l’endothélium et impliquent le cytosquelette endothélial. Comme il s’agit d’une fonction endothéliale vitale, le processus complexe de l’inflammation peut être perturbé à n’importe quel niveau selon Suthahar [16]. Compte tenu de sa grande pertinence par rapport au sujet de notre travail, nous présentons une description plus détaillée pour montrer à quel point l’ensemble du processus est sensible, par exemple en cas de stress mécanique : une réponse inflammatoire est essentielle en tant que mécanisme de défense physiologique contre, par exemple, les bactéries, les virus et les blessures. Le point de non-retour est la diapédèse des leucocytes. L’évolution ultérieure conduit, dans le cas favorable, à une restitutio ad integrum [restauration à terminer], dans le cas défavorable, à une inflammation chronique avec fibrose, défaut de cicatrisation et éventuellement lésions organiques.
Ley et al. (2007) [17] et Serhan et al. (2007) [18], ainsi que les travaux connexes de Nussbaum et Spe-rando (2011) [19] et [1] [20], constituent des ouvrages importants sur l’état de la science. Selon Ley [17], le processus ordonné dans toutes ses phases est crucial pour son résultat. Nous présentons ici le déroulement non perturbé :
Les leucocytes circulants se déplacent passivement dans le flux sanguin. Dans les veinules postcapillaires, les modifications locales de l’hémodynamique à proximité des sites d’inflammation entraînent une réduction du débit sanguin. Cela augmente la probabilité que les leucocytes entrent en contact avec l’endothélium. L’endothélium est activé pendant quelques heures et exprime des molécules d’adhésion qui conduisent à la fixation des leucocytes. Le « slow-rolling » [roulement lent] des leucocytes est également rendu possible par une autre E-sélectine endothéliale inductible, qui repose sur une activation partielle des intégrines sur les leucocytes [17] (voir Figure 1). Le cytosquelette d’actine est également activement impliqué dans ce processus. D’autres chimiokines, provenant en partie de l’endothélium et en partie de l’espace extracellulaire, activent la liaison étroite et le passage amiboïde des leucocytes dans l’espace extracellulaire. Des changements sélectifs de la perméabilité (fonction de gardien de la cellule endothéliale) permettent à des composants cellulaires tels que les neutrophiles et les monocytes de passer de l’espace intravasculaire à l’espace extracellulaire. De plus amples détails sur les séquences de la diapédèse des leucocytes sont présentés dans des ouvrages de référence [1] [19]. Il existe une interaction intense entre les médiateurs sécrétés par l’endothélium (cytokines) et l’ECR [1] [16]. Les signaux anti-inflammatoires tels que la corticostérone atténuent la gravité et limitent la durée de la phase précoce [16].
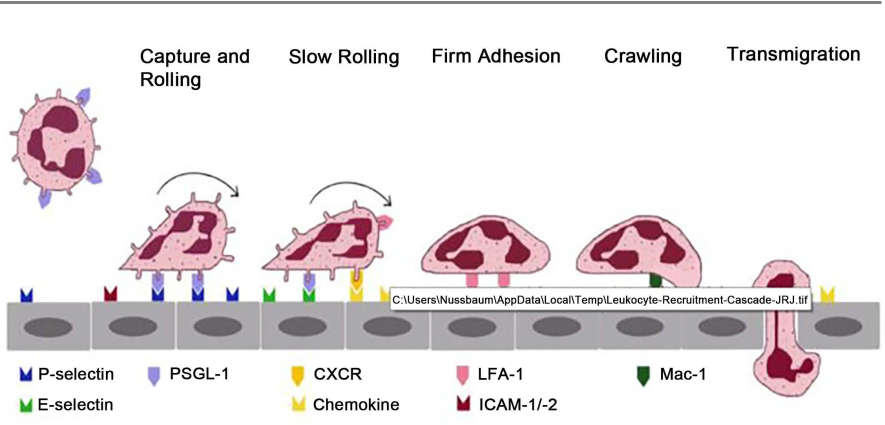
En résumé, le processus d’inflammation est une interaction complexe entre un processus temporel et spatial d’influence mutuelle et d’activation entre des facteurs de l’espace intra- et extravasculaire. Au centre du processus se trouve la fonction adéquate de gardien d’un endothélium en état d’intégrité. Après la diapédèse des leucocytes, un processus ordonné dépend de l’absence de stress oscillatoire et oxydatif accru, afin de conduire à une restitutio ad integrum. Dans l’autre cas, un défaut de cicatrisation peut se produire en raison d’un changement d’équilibre dans le sens d’une inflammation chronique et d’une fibrose. En médecine clinique, le passage à une inflammation chronique et la prévention de celle-ci jouent un rôle important [15].
Les ouvrages de référence de Buckley et al. (2014) [21] et de Serhan et al. (2007) [18] décrivent les séquences qui suivent la diapédèse des leucocytes : Des « points de contrôle » et des « signaux d’arrêt » appropriés empêchent la poursuite de l’entrée des leucocytes. Les lipoxines, les résolvines et les prostaglandines agissent dans le cadre d’un processus actif de pro-résolution. Cela ouvre la voie à la migration et à la différenciation des monocytes vers la phagocytose, à la normalisation du gradient de chimiokines (qui permet aux leucocytes de subir l’apoptose) et à la sortie du tissu par les vaisseaux lymphatiques de drainage. La défaillance de ces mécanismes de régulation peut conduire à un état d’inflammation chronique, provoquant des lésions tissulaires continues et une fibrose progressive. Un exemple classique est l’insuffisance cardiaque chronique par « remodelage » du cœur [16].
Au niveau du cœur, les myofibroblastes immunocompétents et les facteurs de l’ECR modulent activement le développement d’une fibrose d’abord périvasculaire puis progressive. Les points de départ peuvent être le développement d’une myocardite sous une forme chronique, un état après un infarctus du myocarde et/ou une pression mécanique chronique sur le cœur (hypertension systémique ou pulmonaire). La conséquence est l’augmentation de la distance de diffusion, la diminution de la densité capillaire, une altération du système électroconducteur avec arythmie cardiaque, une perturbation de l’angiogenèse, conduisant à nouveau à une détérioration du substrat et de l’approvisionnement en oxygène avec un processus d’autorenforcement : un cercle vicieux [16].
1.4. Forces hémodynamiques
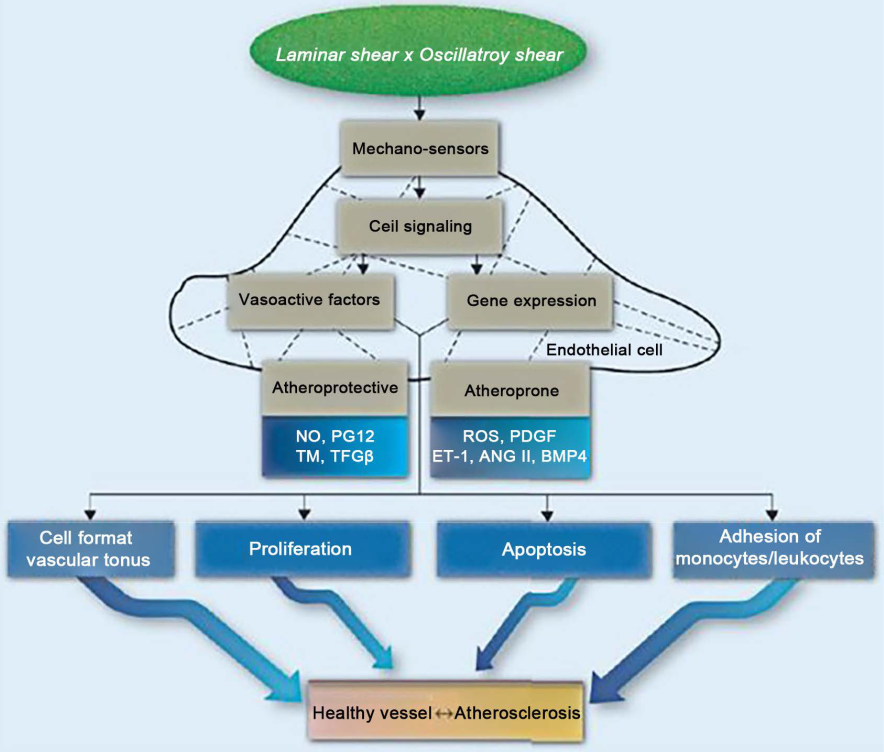
Les forces physiques physiologiques agissent constamment sur l’organisme, par exemple la gravidité, la pression, la contrainte de cisaillement, la vibration. Les principales sont les forces tangentielles (par exemple, la contrainte de cisaillement laminaire) ou les forces d’étirement (par exemple, la distension pulsatile) du sang selon Fernandes, C.D. et al. (2018) [3] et Mazzag et al. (2014) [22]. Comme décrit ci-dessus, les facteurs de stress oscillatoires internes sont physiologiquement limités par la taille des vaisseaux, qui est un facteur critique pour le maintien des fonctions vitales [3]. La régulation de plusieurs processus cellulaires vitaux via des réseaux de mécanotransduction et de signalisation, notamment la croissance, la différenciation, la migration, l’angiogenèse et l’apoptose, est essentielle [1] [3]. Au cours de la morphogenèse, la contrainte de cisaillement dirige la formation de l’arbre vasculaire selon Hahn et Schwartz (2009) [23]. Les variations de la contrainte de cisaillement déterminent des changements vasomoteurs instantanés qui sont régulés « battement par battement » [3] afin de maintenir une contrainte laminaire constante et d’optimiser la fonction de distribution du flux de l’artère conductrice. En même temps, il est important de s’appuyer sur une libération suffisante de NO [3]. La figure 2 donne un aperçu des différents effets de la contrainte de cisaillement.
1.5. Structure de tenségrité du cytosquelette endothélial
La structure viscoélastique de la « tenségrité » endothéliale constitue la base de la mécanotransduction des forces. Le terme « tenségrité » a été inventé par R. Buckminster Fuller (1975) [24], architecte du dôme géodésique, où la compression discontinue et la tension continue ont été utilisées pour atteindre la plus grande stabilité possible combinée à la légèreté. Des points d’ancrage supplémentaires sont utilisés pour transférer les forces mécaniques aux différents éléments de compression et de tension [25]. Les équivalents au niveau de la cellule endothéliale sont les trois réseaux intercommunicants de filaments protéiques et leurs points d’ancrage.
Les filaments d’actine, en tant que partie élastique, servent à maintenir la forme de la cellule en formant un anneau sous la membrane cellulaire [25] avec un réseau de communication vers les capteurs de flux (mécanosenseurs) et les points d’adhésion focale de la membrane (FAS) — les « points d’ancrage dans le modèle de tenségrité » — ainsi que les jonctions lacunaires intercellulaires (CCAP) [25]. Selon Dudek et al [26], plus de 80 protéines liant l’actine jouent un rôle essentiel dans la génération des forces de traction. L’article original [25] donne un aperçu plus approfondi de ce sujet complexe. En réponse à des stimuli contractiles, les filaments d’actine et de myosine forment des unités parallèles organisées et liées à la membrane, appelées « fibres de stress », qui stimulent le glissement de la myosine le long des filaments d’actine.
Cela conduit à une augmentation de la tension intracellulaire et donc à une contraction cellulaire selon Wang et al. (2009) [27] et Lee et al. (2003) [28]. La fermeture et l’ouverture des lacunes paracellulaires en réponse à l’inflammation, à l’ischémie et aux substances envahissantes (fonction de gardien) sont essentielles selon Patrick Belvitch et al. (2018) [29]. Les filaments d’actine constituent également ce que l’on appelle les microvillosités. Ceux-ci contiennent un faisceau central de filaments d’actine, également ancrés au cytosquelette. Les microvillosités sont présentes dans divers organes (par exemple l’intestin) où elles ont des propriétés de résorption.
Les microtubules constituent l’élément de compression avec des tiges creuses résistantes à la pression, composées d’α— et de β-tubuline [25]. Ils sont reliés à l’ECR par des intégrines (protéines transmembranaires) et soutiennent la structure cellulaire en communiquant avec les filaments d’actine et les filaments intermédiaires, ainsi que la formation des fuseaux pour la mitose.
1.6. Transmission de la force mécanique par mécanotransduction « biophysique
L’observation que de nombreux processus se déroulent manifestement beaucoup plus rapidement que ne le permet la voie mécano-chimique via l’expression des gènes et la synthèse des protéines (à savoir au minimum quelques secondes), a conduit à une recherche intensive sur la structure de « dix grilles » et à la définition de la « voie biophysique ». Celle-ci repose sur des liens physiques directs entre des mécanosenseurs spécifiques de la surface endothéliale et des éléments du cytosquelette. Elle permet aux cellules de transférer des stimuli mécaniques sur de longues distances et, ce qui est très important, une excitation spatialement hétérogène pour transformer l’information en une réaction souhaitée [27]. Un travail crucial avec une pertinence importante pour notre travail est la recherche sur la dynamique et la distribution de la transmission en réponse à un « flux bruyant » de Bori Mazzag et al. 2010 [30] et Maz-zag B, Gouget C, Hwan Y, Barakat AI 2014 [22]. Par écoulement « bruyant », les auteurs entendent un « écoulement oscillant ou turbulent dans des conditions de fluctuations aléatoires des propriétés d’écoulement de la pression et de la vitesse », Citation Mazzag, Barakat 2010 page 912 [30].
Les prédécesseurs dans l’exploration de la « voie biophysique » au début des années 2000 ont été Wang et al [8] et Davies et al (2005) [31]. Des travaux importants ont été réalisés dans ce contexte par Helmke et al [32], Hsu, H. J., Lee, C.F, Locke, A. et al (2010) [33] ; Hwang, Y., Gouget, C. L. M et Barakat, A. I. (2012) [34].
Pour mieux comprendre la dynamique de la transmission de la force par les filaments du cytosquelette, un certain nombre de modèles mathématiques ont été développés. Les auteurs Mazzag et Barakat en présentent un aperçu (possibilités et limites) dans [22].
Le modèle de réseau temporel, tel que présenté dans (2010) [30] et (2014) [22], est basé sur une structure viscoélastique d’un modèle de tenségrité, afin de développer une compréhension de la transmission des flux « bruyants » et de définir quelles structures de transmission sont sensibles aux flux « bruyants ». Ce modèle est illustré à la figure 3.
Les résultats montrent que l’amplitude des oscillations dans le flux « bruyant » suscite une réponse plus forte que sa durée. Une autre implication importante est que les FAS (Focal adhesion points – points d’ancrage égaux aux ECR), en raison de leur grande sensibilité au bruit, sont des candidats de choix pour jouer le rôle de « détecteurs de bruit » cellulaires [30].
Une évaluation sommaire suit dans Mazzag 2014 [22] avec d’autres développements de modèles, par exemple pour la distribution spatiale des forces mécaniques pendant la transmission comme le Spatial temporal network Model ; selon les auteurs [22], il y a eu d’importantes contributions des articles originaux de [34] et Mazzag et Barakat (2011) ainsi que Mazzag et al. (2003).
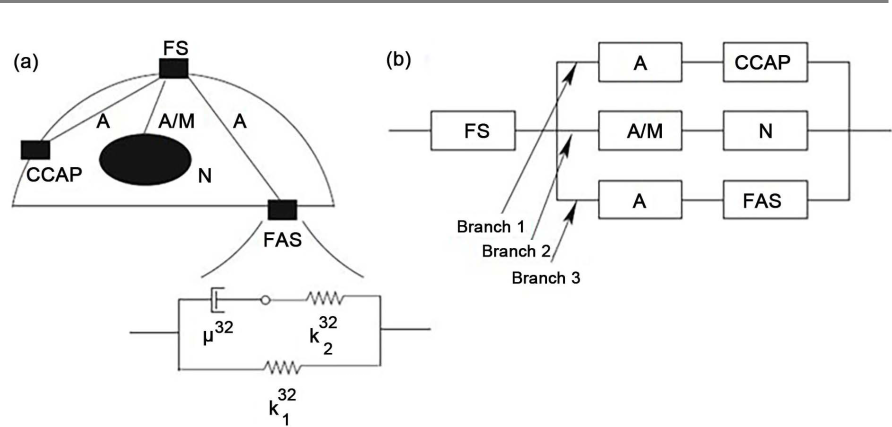
En résumé, les résultats fournissent la forte dépendance de fréquence de la transmission de force avec la définition d’une valeur seuil pour les filaments d’actine (plus sensible) et les microtubules.
Une autre question pour les auteurs était le comportement de saturation lorsque le signal persiste et une explication, comme quoi les fréquences naturelles, générées par les organes de l’organisme lui-même, ne conduisent pas à une longue propagation de la transmission. Nous citons les auteurs Mazzag et Barakat 2014 p. 107 [22] :
“Dans le cas d’un forçage oscillatoire, la contrainte liée à la déformation, comme dans le cas d’un forçage constant, présente un transitoire initial avant de finir par saturer en une réponse stable périodique dans le temps. Il est important de noter que l’amplitude de saturation de la contrainte liée à la déformation au niveau du noyau dépend fortement de la fréquence du forçage. Les figures 3D et E illustrent l’amplitude de saturation de la contrainte liée à la déformation au niveau du noyau en fonction de la fréquence de forçage pour le forçage transversal et axial, respectivement. Dans les directions axiale et transversale, un stimulus mécanique à basse fréquence (<0,1 Hz) est transmis au noyau sans diminution de son amplitude, alors qu’un stimulus mécanique à haute fréquence subit une diminution significative de son amplitude. Cela implique que les fibres de stress individuelles agissent comme des filtres passe-bas du forçage mécanique. Il est intéressant de noter que le mouvement transversal présente une largeur de filtre beaucoup plus importante que le mouvement axial : la largeur de filtre pour le mouvement transversal s’étend jusqu’à f ~ 1000 Hz alors que celui pour le mouvement axial ne s’étend que jusqu’à f ~ 1 Hz” […] (Remarques : citation en lettres italiques).
Deuxième citation importante, page 101 [22] :
“Comme nous l’avons déjà décrit, il a été rapporté que le flux oscillatoire induit un dysfonctionnement des CE et qu’il est en corrélation avec le développement de lésions athérosclérotiques précoces. Par conséquent, nous avons également étudié la réponse des réseaux simples décrits dans le paragraphe précédent à un flux oscillatoire. Les résultats ont révélé que la déformation maximale (définie comme la plus grande déformation au cours d’une période après que le comportement asymptotique temps-périodique est atteint) de chacune des structures du réseau (mécanocapteur, fibres de stress d’actine, microtubules et noyau) est fortement dépendante de la fréquence. À des fréquences oscillatoires suffisamment basses, les déformations maximales correspondent à celles d’un forçage constant ; toutefois, au-delà d’une fréquence seuil, les déformations maximales chutent de manière significative. L’analyse a démontré que cette fréquence seuil se situe entre 10-5 et 10-4 Hz pour les microtubules et entre 10-3 et 10-2 Hz pour les fibres de stress d’actine, ce qui suggère que les fibres de stress peuvent transmettre efficacement la force sur une gamme de fréquences plus large. […] » [Remarques : lettres en italique de ma part]
Les recherches expérimentales de Na et al. (2008) [35] ont comparé la vitesse de la mécanotransduction via la voie biophysique et via la voie mécanochimique (facteur de croissance et expression génétique). Les auteurs ont utilisé des expositions physiques comparables pour les infrasons (0,3 Hz), une durée de 30 s, une pression sonore de 1,8 Pa (études avec 1,8 Pa jusqu’à environ 20 Pa). Les résultats les plus importants ont été la confirmation que la vitesse était 40 fois plus rapide que par des moyens mécaniques et chimiques (confirmant les résultats ci-dessus), à savoir 300 ms (millisecondes). En outre, les résultats ont montré que « l’activation de Src induite par le stress dépend de l’activation de l’intégrine, de la rigidité du substrat, de la précontrainte et de l’intégrité de la F-Actine » [35], citation de Na et al. page 1. Remarques : en italique (de ma part) [35].
1.7. Les mécanocapteurs de la cellule endothéliale
Selon [3], le cytosquelette lui-même est un mécanocapteur. Du côté du vaisseau (luminal), les mécanocapteurs sont surtout le glycocalyx, les intégrines, les jonctions cellule-cellule (CCAP), les cavéoles, les radeaux lipidiques, les récepteurs couplés aux protéines G et les canaux ioniques. Ils sont activés en fonction de leur localisation par la contrainte de cisaillement [3] (Figure 4). Selon l’auteur [3], les mécanosenseurs endothéliaux sont modifiés dans leur microenvironnement par la contrainte de cisaillement et peuvent activer des voies de signalisation intracellulaires dans cette nouvelle formation. La fluidité des microdomaines de la membrane plasmique est modifiée [3]. Cela conduit, selon [3], à un réarrangement spatial de diverses protéines et donc à l’activation de voies de signalisation. La transmission des forces s’effectue via les trois réseaux de communication du cytosquelette vers la région basale du cytosquelette (par exemple, les intégrines) [3] [22] [30].
L’un des plus importants mécanocapteurs est le glycocalyx ([1] [3] Figure 4). Chez les patients gravement malades, l’étendue des dommages subis par le glycocalyx (ce que l’on appelle le shedding) est en corrélation avec la gravité de la maladie et la mortalité [1] [36] [37].
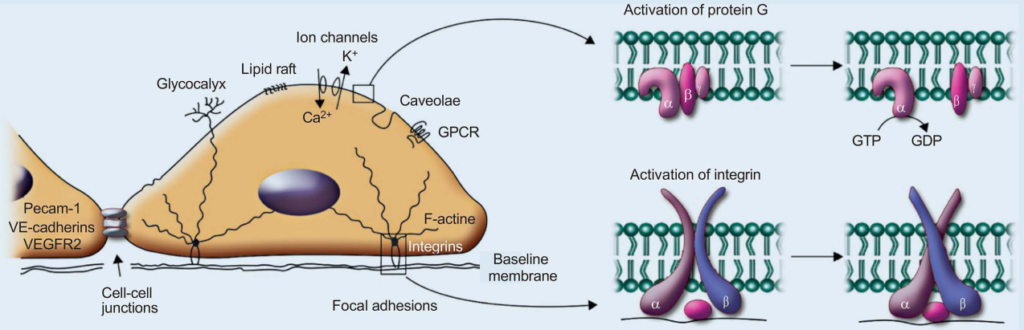
Comme ceux identifiés à ce jour, les mécanocapteurs sont présentés dans la figure 4 (état 2019).
1.8. Canaux PIEZO-1
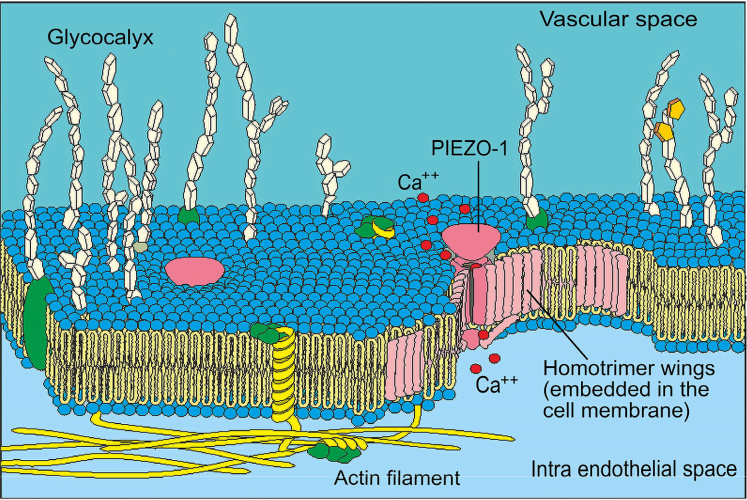
D’autres mécanocapteurs endothéliaux récemment définis, les canaux PIEZO-1, ont été clairement établis comme un système sensoriel des organes internes par les récepteurs de pression et de vibration dans tous les vaisseaux. Ardem Patapoutian a reçu le prix Nobel de médecine en 2021 en raison de l’importance de cette découverte. Selon Rode et al. (2017) [38], Piezo-1 est responsable des canaux cationiques sensibles au flux, non inactivants et non sélectifs qui dépolarisent le potentiel de la membrane : Les canaux Piezo-1 perméables au Ca2+ sont activés par une force physique sur la membrane cellulaire (comparer la figure 5). Les PIEZO-1 détectent l’activité physique du corps entier pour rétablir l’homéostasie cardiovasculaire et améliorer les performances. Ils sont essentiels à la lymphogenèse et à l’homéostasie et sont d’importants mécano-senseurs de la contrainte de cisaillement [39]. Les canaux PIEZO sont essentiels dans tous les organismes multicellulaires, c’est-à-dire également chez les invertébrés tels que les mouches et les vertébrés (poissons) [40]. La figure 5 présente une représentation schématique d’un canal PIEZO-1 intégré.
2. Bruit, son et infrasons
Dans la Classification internationale des maladies (CIM-10) (2010), publiée par l’Organisation mondiale de la santé (OMS), l’« exposition au bruit » (rubrique W42) figure sous la rubrique « Exposition à des forces mécaniques inanimées » (rubriques W20 à W49) [41].
En effet, les ondes de pression qui se propagent dans l’air (c’est-à-dire le son) ont un impact sur les tissus viscoélastiques des organismes biologiques en tant que forces mécaniques externes.
Dans la CIM-11 (2020), plus récente, des codes d’extension supplémentaires (section X) ont été établis et l’« exposition au bruit » (rubrique XE7Y1) relève désormais des catégories « Causes externes/Exposition à un autre mécanisme » [42]. L’affection « Vertige dû à des infrasons » (rubrique T75.2 dans la CIM-10) dans la rubrique « Effets des vibrations » relève désormais de la catégorie « Autres effets spécifiés des vibrations » (rubrique NF08.2Y).
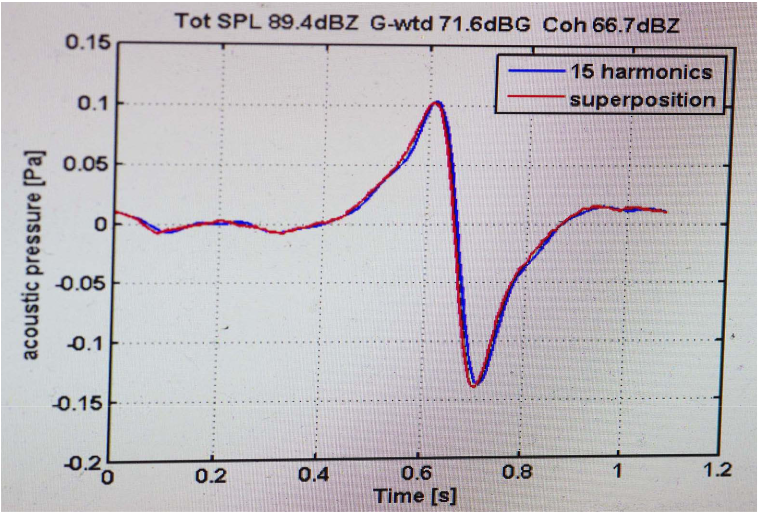
Les infrasons sont définis comme des sons dont la fréquence est inférieure à 20 Hz. Le bruit de basse fréquence (IFLN), qui n’est pas clairement défini selon la norme DIN 45680, est limité à 125 Hz. Plus la fréquence est basse, plus la longueur d’onde est grande. Les infrasons ne peuvent être que faiblement amortis, ils sont moins atténués par la propagation dans l’atmosphère ainsi qu’à travers les toits et les murs que le spectre audio. Par exemple, la propagation du son dans l’air avec une longueur d’onde de 0,1 Hz est d’environ 3,3 km (condition standard de 20 degrés Celsius), celle de 1000 Hz est d’environ 34 mm. Les infrasons sont générés par des masses lourdes en mouvement ainsi que par des phénomènes de résonance/vibration. L’exposition peut être professionnelle ou résidentielle, et peut être émise par des sources naturelles (par exemple, les tremblements de terre) ou techniques (trains, avions, sources professionnelles ou résidentielles). Les émetteurs diffèrent en termes de fréquence, de pression acoustique P (Pa), de profil temps/effet (impulsivité) et de durée. L’augmentation du nombre et de la taille des rotors des TVN entraîne une augmentation des plaintes [43]. Plus le rotor est grand, plus la fréquence émise est basse. D’après [44] [45], les infrasons émis par les TVN se situent en grande partie dans la plage de 0,1 à 10 Hz. Son émission d’infrasons est impulsive dans le profil effet/temps selon Roos W, Vahl, CF (2021) [45] et Vanderkooy [46], comme le montre la figure 6.
Les lois physiques de la théorie des ondes s’appliquent à la propagation du son, par exemple sous forme d’onde longitudinale ou transversale et avec différentes vitesses de propagation (dans un milieu fluide, environ trois fois plus rapide que dans un gaz). Le comportement de propagation dépend des différents milieux élastiques, qu’ils soient liquides, gazeux, solides ou un mélange de ceux-ci ; il en va de même pour l’organisme viscoélastique. Le son étant une onde mécanique, la propagation peut être réfractée, réfléchie, interférer et être transmise [47]. La propagation d’une onde est un transport d’énergie, mais pas un transport de matière. Lors de la propagation, les particules sont mises en oscillation. En outre, dans les espaces intérieurs des bâtiments, des interférences entre la pression acoustique de l’air et les bruits de structure sont possibles, ce qui peut également entraîner des amplifications ou des atténuations importantes du son d’impact total [48].
3. L’hypothèse/la théorie
3.1. La différence par rapport à la pensée actuelle
Les études épidémiologiques existantes considèrent presque exclusivement l’organe audio-vestibulaire, ou l’implication de structures cérébrales individuelles [49], comme des organes susceptibles d’être affectés par l’exposition au bruit dans les gammes de basses fréquences. Par rapport aux champs électromagnétiques, tout le monde accepte que les impacts sur l’organisme ne dépendent pas de la perception. Pourquoi pas ici ? Cette question a déjà été posée en 2007 [50]. De nombreux troubles de la santé ou symptômes cliniques manifestes ne peuvent être expliqués par un impact purement audio-vestibulaire. Depuis 2015 environ, l’auteur a remarqué de nombreuses plaintes dans le monde entier en raison de la situation résidentielle. Elles correspondent à des troubles fonctionnels de la microcirculation en raison d’une biodisponibilité réduite et non coordonnée du NO.
Il s’agit, par exemple, de vertiges, de troubles des performances scolaires, de fatigue, d’acouphènes, de faiblesse musculaire et de maux de tête, signes d’un soutien perturbé et inadéquat en nutriments et en O2. En cas d’exposition chronique, des symptômes apparaissent tels que l’augmentation de la pression artérielle, l’arythmie cardiaque, les troubles respiratoires, les déficiences immunitaires et l’épilepsie tardive [50]. Dans un deuxième temps, une hypothèse de travail a été élaborée pour tester les conditions préalables à un effet direct du facteur de stress au niveau des cellules endothéliales et sur le plan technique. Les résultats disponibles à ce jour des études épidémiologiques, expérimentales et animales ont été inclus dans les considérations.
Dans un troisième temps, la littérature actuellement disponible sur la physiologie et la physiopathologie moléculaires de l’endothélium a été examinée sous l’angle de la possibilité d’une mécanotransmission des forces mécaniques si elles sont soumises à un facteur de stress externe. L’identification des canaux PIEZO-1 2021 en tant que mécanosenseurs importants pour le son et les vibrations a renforcé les preuves de notre hypothèse. Une abondante littérature sur les résultats pathohistologiques de l’exposition professionnelle aux infrasons dans les années 1980 [50], puis dans les années 2000 sur l’exposition des résidents aux éoliennes [51] et la réévaluation de ces résultats ont été incluses.
En raison de l’approche audio-acoustique, les conditions modifiées de propagation du son dans l’organisme viscoélastique n’ont pas été prises en compte dans le passé. Nous le faisons maintenant. Pour la même raison, le seuil de perception n’est pas pertinent, car il ne concerne que les sons audibles et la transmission par l’air.
3.2. L’hypothèse est basée sur les preuves de :
– Le bruit est une force mécanique, donc soumise à des lois physiques ;
– L’existence de nombreux mécanosenseurs pour le son et les vibrations au niveau de la membrane et de l’endothélium avec des canaux PIEZO-1 nouvellement identifiés, en particulier au niveau de l’endothélium, est à la pointe de la science ;
– La mécano-transduction des forces mécaniques est cruciale pour de nombreuses régulations vasculaires vitales ;
– La transmission mécanique des forces par les structures du cytosquelette endothélial est à la pointe de la science ;
– Excitabilité microtactile prouvée des cellules endothéliales avec conduction rapidement propagée en amont et en aval.
3.3. Notre hypothèse
– Le bruit, lorsqu’il affecte les organismes, est, dans certaines conditions de fréquence, de pression acoustique, d’effet/profil temporel, de durée, capable de modifier la situation physiologique d’écoulement laminaire dans le lit capillaire dans le sens d’un environnement oscillatoire. Dans ce cas, la transition des forces mécaniques peut avoir lieu de manière incontrôlée ;
– En conséquence, les fonctions vasomotrices et en particulier la vasomotion peuvent être perturbées ;
– Les effets attendus d’un impact chronique pourraient conduire à une insuffisance chronique de l’apport en nutriments et donc à un déplacement des équilibres vers des déséquilibres, en particulier pour les systèmes d’oxydoréduction et pour les réponses aux processus d’inflammation.
4. Évaluation de l’hypothèse
La première condition de base qui s’applique à notre hypothèse est la question de savoir si l’exposition au « bruit », dans le sens d’un facteur de stress oscillatoire, provoque à son tour un champ oscillatoire dans le lit capillaire.
4.1. Soutien positif aux données probantes
La réactivité des mécano-senseurs endothéliaux aux influences extérieures telles que la gravité, la pression, le gonflement et le bruit en est la preuve [1] [3] [22] [30] ainsi que l’excitabilité microtactile des cellules endothéliales [5]. Il existe également des preuves que les infrasons interagissent avec le métabolisme cellulaire et entraînent une fibrose périvasculaire chez les rats, d’après Lousinha (2018) [52]. Des résultats similaires sont présentés dans [53] [54] [55]. Les données empiriques des études expérimentales montrent clairement que l’exposition à l’IFLN entraîne une augmentation des ROS [56]. Des preuves positives ressortent également de l’étude de Chaban et al [57] et, fait très notable, l’effet direct sur les cellules est démontré dans l’étude intitulée Effect of infrasound on the growth of colorectal carcinoma in mouse (Effet des infrasons sur la croissance du carcinome colorectal chez la souris) [58]. En médecine clinique, on s’interroge actuellement sur les avantages possibles des infrasons dans le traitement du carcinome colorectal humain. Les résultats de la revue de Roos, W et Vahl, CF (2021) [45], qui se concentrent sur les preuves de l’interaction des structures cellulaires, respectivement des structures membranaires sensibles, dans une réaction de stress, apportent de nombreuses preuves d’un effet direct sur les cellules et les membranes. Une perturbation possible de la microcirculation est discutée. Une évaluation positive dans cette direction est également l’analyse de Dumbrille, A et al. (2021) [59] : Cette évaluation aboutit à la causalité des effets néfastes sur la santé (ADH) et du facteur de stress dans tous les « critères de Bradford Hill ». Des effets indésirables sur les animaux ont été signalés, qui ont révélé non seulement des réactions de stress, mais aussi des effets négatifs sur la fertilité, le développement et la reproduction [60]. En ce qui concerne le critère de Bradford-Hill, les analyses ont montré une détérioration manifeste des performances mentales des habitants vivant dans un rayon de 1,4 km autour des éoliennes et de ceux vivant en dehors de ce rayon [61]. Les plaintes augmentent lorsque les fréquences s’approchent des plus basses (dans l’exemple mentionné, 0,2 Hz) [62].
La « nurse cohort study » (étude de cohorte d’infirmières) présente des preuves positives de la fréquence de la fibrillation auriculaire [63]. Voici ce que j’en pense : le développement de la fibrillation auriculaire en l’absence d’hypoxémie correspond à des changements structurels et donc à des conditions de perturbation de l’électromécanique.
4.2. Réévaluation des découvertes pathohistologiques
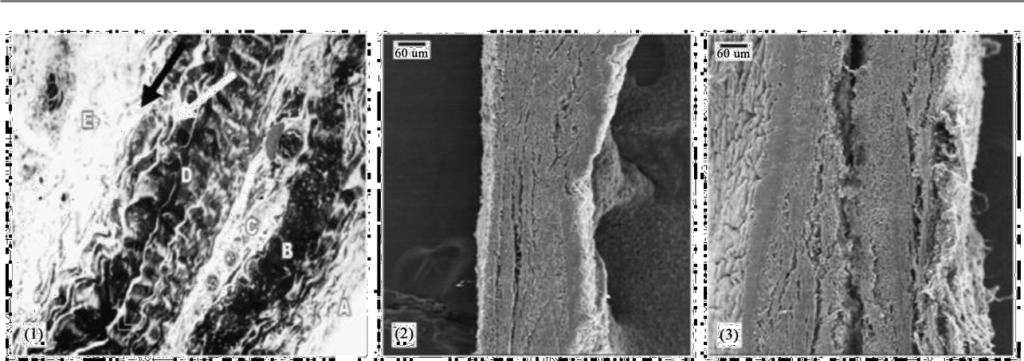
Des recherches [50] sur la symptomatologie des groupes confrontés à l’IFLN dans les années 1980 ont montré un épaississement de la paroi des vaisseaux. Selon les auteurs, les études animales ont montré une quantité anormale de fibrose/collagène dans la trachée, les poumons et la plèvre ; des cils trachéaux et bronchiques endommagés (cisaillés) ; des microvillosités à base d’actine fusionnées dans les cellules en brosse de la trachée et des bronches. L’épaississement de la paroi péricardique a été observé chez des personnes exposées professionnellement à l’ILFN [50] et chez des personnes vivant à proximité de grandes centrales thermiques [51] comme une altération spécifique. La figure 7 montre l’épaississement de la paroi péricardique chez des personnes exposées professionnellement de manière chronique dans les années 80 (appelé syndrome vibroacoustique « syndrome VAD ») par rapport à des personnes non exposées.
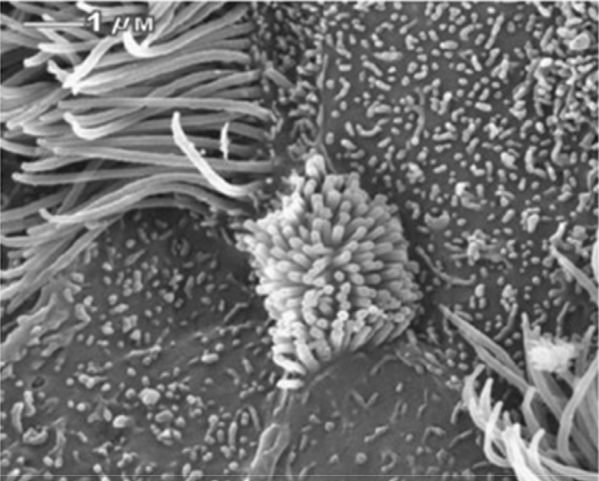
La figure 8 présente l’épithélium bronchique non exposé d’un rat en comparaison avec l’épithélium exposé de la figure 9. Les figures montrent les changements dans les microvillosités (actine) avant et après l’exposition. L’interprétation de ces résultats suggère un changement dans l’homéostasie du système d’oxydoréduction vers l’inflammation chronique et la fibrose.
4.3. Soutien éventuellement négatif aux éléments de preuve
Le choix des niveaux de pression acoustique (SPL) en dB dans les études expérimentales est souvent plus élevé que ce que l’on attend des installations IWT.
Objection :
a) Le niveau de pression acoustique en dB (A) ne peut représenter le bruit aérien que dans la partie fréquentielle de l’ouïe (voir cap. 2).
b) L’effet du goutte-à-goutte régulier lorsque l’on vit à proximité des émissions doit être considéré comme un facteur important [64], la durée d’exposition dans la réalité peut souvent être (également pour les groupes sensibles) de 24 heures sur 24, 7 jours sur 7, par jour. En revanche, la durée des études expérimentales sur les animaux est limitée pour des raisons pratiques. Il en va de même pour les pressions sonores plus élevées dans le contexte de l’exposition professionnelle : dans ce cas, les durées d’exposition sont limitées ; les groupes sensibles n’y ont pas accès.
Cependant, le facteur décisif est que la fréquence du bruit n’a pas été reconnue dans son importance (par exemple, l’utilisation de 8 Hz dans Chaban et al. [57]). A cela s’ajoute : le comportement de la propagation du son dans les organismes viscoélastiques diffère à tel point qu’une information décodable sur les filtres passe-bas devient concevable (comparer cap. 2) [22] [30] [35].
Étude Exemplum Poulsen [65] : En conséquence, il n’a trouvé aucune association statistiquement significative entre l’exposition aux infrasons et l’incidence des maladies cardiovasculaires. L’auteur lui-même a relativisé l’étude (par exemple, étude sur un nombre relativement faible de TVN).
4.4. Évaluation des études informatiques
Des parties importantes des déclarations de Mazzag et Barakat 2010 [30] et 2014 Mazzag et al. [22] sont basées sur des modèles informatiques. Comme nous l’avons déjà mentionné, les auteurs eux-mêmes font référence aux limites et aux résultats possibles.
Citation des auteurs [22] Page 96 :
« Il est donc essentiel que les modèles soient validés dans la mesure du possible par rapport aux données expérimentales. Ce n’est qu’après une telle validation que les modèles mathématiques peuvent potentiellement tenir leur promesse de fournir des outils puissants et prédictifs pour étudier la dynamique et l’organisation spatio-temporelle des réponses induites mécaniquement dans les cellules ».
Ma déclaration : Plusieurs prédécesseurs [27] [33] [34] [35] ont effectué des travaux préparatoires essentiels pendant des années, avec des preuves solides ; l’ensemble du processus de mécanotransmission est hautement dynamique, avec de nombreuses voies imbriquées les unes dans les autres. Des modèles informatiques sont nécessaires pour obtenir la meilleure approximation possible des processus dynamiques afin d’améliorer la compréhension de la mécanotransduction cellulaire. Le travail complémentaire de Na (2008) [35] en tant qu’étude expérimentale est l’une des études expérimentales requises, qui confirme les modèles mathématiques. Aucune étude dans ce sens n’a été réalisée sur des sources techniques émettant des infrasons.
4.5. Régulation extrinsèque supplémentaire de la microcirculation
L’influence de la partie extrinsèque sur la fonction vasomotrice via le système nerveux autonome est la partie variable qui dépend fortement des capacités individuelles à compenser les facteurs de stress. Il s’agit d’un facteur d’influence supplémentaire qui explique probablement pourquoi des personnes se trouvant dans le même environnement ne réagissent pas de la même manière dans leur symptomatologie. La comparaison entre une charge de stress à court terme et une charge de stress permanente permet d’envisager les résultats suivants : au bout d’un certain temps, les possibilités de compensation des systèmes biologiques sont épuisées.
4.6. Premières recherches et méthodes proposées
Pour plus de confirmation, nous proposons un plan expérimental avec un nombre déterminé de sujets exposés aux infrasons par rapport à des sujets non exposés. Le groupe positif est exposé à un agent stressant infrasonore défini en termes de fréquence, de pression acoustique p in (Pa), de profil temps/effet (impulsivité) et de durée. Il s’agit d’une étude en double aveugle, en mode marche/arrêt, avec la technique de vidéomicroscopie SDF, qui permet d’examiner la vasomotion sensible de la muqueuse buccale. Des expériences animales correspondantes sont envisageables pour évaluer les modifications vasomotrices directes sous infrasons (par exemple chez le hamster via la joue). Les indications sur les modifications du comportement animal et du comportement reproductif chez les vertébrés et les non-vertébrés constitueraient un complément significatif et une extension de la clarification scientifique.
4.7. Importance de notre recherche
La santé vasculaire est étroitement liée à la biodisponibilité du NO. La classification des éventuels facteurs environnementaux nuisibles est d’une grande importance pour le maintien de la santé vasculaire. Les groupes de population particulièrement sensibles doivent être le banc d’essai. Notre hypothèse peut aider à définir les stades sensibles à la mécanotransmission de fréquences profondes de « bruit ».
5. Méthodes établies pour évaluer et visualiser les processus microcirculatoires
La microcirculation peut être visualisée in vivo sur les nouveau-nés via la peau, sur les adultes via la muqueuse buccale [1]. Les changements, en particulier dans la vasomotion, peuvent être détectés immédiatement et sont reproductibles. Les techniques appropriées sont les techniques de vidéomicroscopie telles que l’imagerie SDF (side stream dark field). Une meilleure visualisation de la microcirculation in vivo est devenue possible [66]. La microcirculation dans le contexte des maladies peut être visualisée et quantifiée immédiatement après l’exposition au facteur de stress, ainsi qu’en son absence. Les paramètres qui peuvent être spécifiquement observés sont les suivants :
– La vasomotion intacte en premier ordre
– Un changement instantané de la vasomotion sous l’effet d’un facteur de stress défini
– La densité fonctionnelle des vaisseaux sanguins (FVD) (mm/mm2)
– La vitesse d’écoulement des globules rouges (RBCV)
– Nombre de capillaires perfusés (N/A) (n/mm2)
– Diamètre du vaisseau capillaire (DM)
– L’épaisseur du glycocalyx en μm (envisageable pour d’autres projets de recherche).
6. Pistes de recherche proposées ; questions relatives à la cible
– Dans quelles conditions définies le bruit ayant certaines propriétés affecte-t-il la transduction mécanique des signaux au niveau cellulaire (par exemple les composants membranaires, le cytosquelette) et/ou l’interaction cellule-cellule ?
– Quels sont les mécanosenseurs, les structures définies, qui sont spécifiquement sensibles ? Quel rôle jouent les canaux PIEZO-1 ?
– Quelle pression acoustique est nécessaire à une certaine fréquence pour obtenir une réponse de transfert ?
– Quel rôle spécifique jouent les effets de résonance ?
– Quel est le rôle spécifique des canaux PIEZO-2 dans la perception des fréquences profondes ?
– Quels sont les paramètres permettant de mettre en évidence l’émergence d’un déséquilibre du système redox et de distinguer en même temps l’aggravation de l’athérosclérose dans ses causes ?
7. Les conclusions
Pour la première fois, la symptomatologie des humains et des animaux exposés de manière chronique aux infrasons peut être classée de manière physiopathologique dans une hypothèse cohérente. Cela a été rendu possible par les progrès réalisés dans la connaissance de la mécano-transduction endothéliale, essentielle en tant que fonction vasculaire de caractère vital en réponse à des forces mécaniques. Des processus cellulaires cruciaux tels que la croissance, la différenciation, la migration, l’angiogenèse, l’homéostasie redox et l’inflammation dépendent simultanément des forces mécaniques et de l’intégrité de l’endothélium.
Normalement, le flux dans la microcirculation des mammifères est laminaire et non variable. Cela est dû à la connexion en amont des vaisseaux de résistance dans les artérioles. Des changements persistants dans les modèles de contrainte de cisaillement, en particulier le flux oscillatoire, ont été associés à une diminution de la biodisponibilité du NO, à une augmentation des espèces réactives de l’oxygène (ROS), à des taux d’oxydation des lipoprotéines plus élevés, à une augmentation de l’apoptose endothéliale, à une pro-athérogénicité, à une inflammation chronique et à un développement possible du cancer. Nous avons des preuves positives de notre hypothèse selon laquelle un agent stressant oscillant agissant de manière chronique et présentant certaines conditions en termes de fréquence, de profil temps/effet, de pression sonore et de durée peut induire un champ de stress oscillant et donc déclencher une réaction de stress au niveau cellulaire. Avec les bases cruciales de la mécano-transduction, il existe maintenant des preuves solides et des indicateurs évidents d’une interaction possible des infrasons, en particulier avec des fréquences profondes et un caractère impulsif, comme c’est le cas, par exemple, avec les IWT ou les pompes à chaleur. L’élucidation de la forte dépendance de la mécanotransduction par rapport à la fréquence du « bruit » et l’identification des filaments d’actine et des microtubules en tant que « filtres passe-bas » confirment notre hypothèse. Ainsi, la propagation de l’onde sonore dans l’organisme viscoélastique pourrait devenir une information décodable. La régénération, qui se produirait lors d’une exposition unique ou peu fréquente, ne pourrait pas avoir lieu en cas d’impact chronique. Dans un premier temps, on peut s’attendre à des perturbations fonctionnelles du système vasomoteur orchestré, respectivement de la vasomotion sensible, puis, avec une exposition plus longue, à des lésions pathologiques anatomiquement reconnaissables de l’intégrité endothéliale. Dans ce contexte, les changements structurels qui tendent à s’autorenforcer, comme décrit dans l’exemple du remodelage du cœur, sont importants. En élucidant probablement la voie physiopathologique par laquelle les infrasons/IFLN peuvent conduire aux principaux troubles de la santé, il sera possible de progresser dans la définition de distances de sécurité pour vivre ou travailler avec des installations techniques émettrices. De nombreuses questions scientifiques restent sans réponse, mais il existe suffisamment de preuves pour suggérer que, par mesure de précaution, les nouvelles technologies impliquant des fréquences très basses et/ou des émissions impulsives ayant un impact potentiel sur les organismes vivants devraient être limitées ou mieux évitées jusqu’à ce que toutes les questions soient scientifiquement résolues. Les effets possibles sur les insectes, qui n’ont pas encore été clarifiés, pourraient être d’une grande importance, par exemple pour la biodiversité et la coopération des pollinisateurs, et donc pour la nutrition.
Le décodage des canaux PIEZO-1 aurait déjà dû alerter le public sur les risques potentiels. Les organes internes sont sensibles aux sons et aux vibrations. L’état actuel des connaissances sur la mécano-transduction ainsi que les effets connus du stress oscillatoire et oxydatif vont dans le sens de notre hypothèse et devraient justifier des mesures de précaution urgentes et des recherches plus approfondies.
Remerciements
Werner Roos, chef émérite du département de biologie pharmaceutique à l’université Martin Luther de Halle, pour son examen critique et ses contributions constructives. Je remercie Manfred Krueger, Berlin, graphiste pour la figure 5.
Clause de non-responsabilité
L’auteur n’a aucun conflit d’intérêts. L’auteur souhaite préciser que : les formes alternatives d’énergie renouvelable, telles que les éoliennes industrielles, sont considérées comme des compléments utiles sur des sites appropriés. Il en va de même pour les installations de biogaz, les pompes à chaleur et les centrales thermiques de type bloc. Les données présentées ici ont été examinées dans le cadre d’un seul et unique programme, celui de la recherche scientifique pure. Il n’y a aucun accord commercial, financier ou professionnel.
Conflits d’intérêts
L’auteur ne déclare aucun conflit d’intérêts concernant la publication de cet article.
Références
⚠ Les points de vue exprimés dans l’article ne sont pas nécessairement partagés par les (autres) auteurs et contributeurs du site Nouveau Monde.




















