18/12/2022 (2022-12-18)
[Source : jeremyrhammond.com]

Par Jeremy R. Hammond — 8 décembre 2022
[Traduction : Jean Bitterlin]
L’affirmation du CDC selon laquelle la quantité d’aluminium à laquelle les enfants sont exposés par son programme de vaccination est « sûre » équivaut à une fraude scientifique.
Sommaire :
- Introduction
- Les raisons de la présence de l’adjuvant aluminium
- Absence de groupes témoins placebo et « effets non spécifiques » des vaccins
- La « limite de sécurité » de la FDA pour l’exposition à l’aluminium par rapport au calendrier des vaccins
- Le « niveau de risque minimal » falsifié de la FDA pour l’aluminium
- Aluminium injecté comparé à l’aluminium ingéré
- Ignorer la toxicité des particules d’aluminium
- Conclusion
1. Introduction
L’une des préoccupations légitimes qu’ont de nombreux parents au sujet de l’adhésion au programme de vaccination systématique des enfants recommandé par les Centres américains de contrôle et de prévention des maladies (CDC) est que de nombreux vaccins contiennent de l’aluminium, qui est utilisé comme « adjuvant ».
Sur une page de son site web titré Adjuvants and Vaccines, le CDC explique les raisons de la présence de l’aluminium en disant, « Un adjuvant est un ingrédient utilisé dans certains vaccins qui permet d’obtenir une réponse immunitaire plus forte chez les personnes recevant le vaccin. En d’autres mots, les adjuvants permettent aux vaccins de mieux fonctionner.
Pour rassurer le public, le CDC déclare que « les sels d’aluminium, tels que l’hydroxyde d’aluminium, le phosphate d’aluminium et le sulfate d’aluminium ont été utilisés en toute sécurité depuis plus de 70 ans ». Le CDC dit que les vaccins qui contiennent de l’aluminium « sont testés pour la sécurité et l’efficacité dans des essais cliniques avant qu’ils ne soient autorisés à être utilisés aux États-Unis » et qu’ils sont « surveillés en permanence par le CDC et la FDA une fois qu’ils ont été approuvés ».
La page a été récemment mise à jour pour tenir compte du fait qu’une étude du CDC publiée en septembre 2022 a révélé « une association positive entre l’aluminium cumulé associé aux vaccins avant l’âge de 24 mois et l’asthme persistant entre l’âge de 24 et 59 mois chez les enfants avec et sans eczéma ». Pour les enfants atteints d’eczéma, le résultat était une augmentation de 26 % du risque d’asthme pour chaque tranche de 1 000 microgrammes (NdT :1 millième de gramme) d’aluminium reçu par vaccination.
Cependant, le CDC minimise ces résultats en décrivant l’étude comme ayant trouvé une association « possible », même si le risque accru d’asthme chez les enfants avec et sans eczéma était statistiquement significatif et que les auteurs de l’étude eux-mêmes reconnaissent qu’une « association positive » a été trouvée. Le CDC décrit en outre l’association entre les vaccins contenant de l’aluminium et un risque accru d’asthme comme un simple signal de sécurité « potentiel », plutôt que de reconnaître qu’il s’agit d’un signal de sécurité existant.
Minimisant ainsi le risque accru d’asthme associé à l’exposition à l’aluminium des vaccins, le CDC persiste dans sa politique et dans son affirmation de longue date selon laquelle « la quantité d’aluminium à laquelle sont exposées les personnes qui suivent le calendrier vaccinal recommandé est faible et n’est pas facilement absorbée par l’organisme ».
« Des recherches scientifiques antérieures ont montré que la quantité d’aluminium à laquelle sont exposées les personnes qui suivent le calendrier vaccinal recommandé est faible et n’est pas facilement absorbée par l’organisme. »
Pour étayer son affirmation selon laquelle les niveaux cumulatifs d’aluminium auxquels les enfants sont exposés dans le cadre du programme de vaccination systématique des enfants sont « faibles » et que l’aluminium est facilement éliminé de l’organisme sans provoquer d’effets toxiques, le CDC cite une étude réalisée par des chercheurs de la Food and Drug Administration (FDA). Cette étude, menée par Robert J. Mitkus et coll. et publiée dans la revue Vaccine en 2011, est intitulée « Updated aluminum pharmacokinetics following infant exposures through diet and vaccination » (Mise à jour de la pharmacocinétique de l’aluminium après l’exposition des nourrissons par l’alimentation et la vaccination).
La FDA cite également l’étude de Mitkus et coll. comme ayant montré que :
« Le risque pour les nourrissons induit par l’exposition totale à l’aluminium reçue de toute la série recommandée de vaccins infantiles au cours de la première année de vie est extrêmement faible ».
Cependant, cette étude ne soutient pas les affirmations du gouvernement sur la sécurité des vaccins. En effet, les affirmations des CDC et de la FDA servent à illustrer le manque total de fiabilité de l’establishment de « santé publique ».
En réalité, l’aluminium est une neurotoxine connue qui s’accumule dans les tissus et les organes, y compris le cerveau, et qui cause vraisemblablement des dommages neurologiques aux enfants aux niveaux cumulatifs auxquels les enfants sont exposés par le calendrier de vaccination systématique des enfants du CDC.
Les inquiétudes concernant les effets toxiques potentiels sur les enfants ont été soulevées dans la littérature médicale, mais le CDC sélectionne les données pour soutenir ses politiques, comme l’illustre la façon dont il cite l’étude de la FDA tout en ignorant délibérément d’autres recherches démontrant les graves erreurs commises par Mitkus et coll. dans leur analyse.
En effet, le fait que ces agences de « santé publique » s’appuient sur l’étude de la FDA pour prouver que l’aluminium contenu dans les vaccins est « sûr » relève de la fraude scientifique pure et simple.
2. Les raisons de la présence de l’adjuvant aluminium
Comme nous l’avons vu, le CDC indique que l’objectif d’un adjuvant est d’aider les vaccins à « mieux fonctionner » en créant « une réponse immunitaire plus forte ».
Ce que le CDC veut dire, c’est que l’ajout d’un adjuvant fait en sorte que le vaccin suscite une réponse immunitaire plus inflammatoire (elicit a more inflammatory immune response), ce qui entraîne l’induction d’un niveau plus élevé d’anticorps circulants (induction of a higher level of circulating antibodies). Cela permet ensuite aux sociétés pharmaceutiques d’obtenir le niveau d’anticorps requis par la FDA pour être considéré comme suffisamment immunogène et donc pour obtenir l’homologation de leurs produits.
Par exemple, dans son document « Summary Basis of Approval (Résumé des motifs d’approbation) » de 1997 pour le vaccin contre la diphtérie, le tétanos et la coqueluche acellulaire (DTaP) de GlaxoSmithKline, vendu sous le nom commercial Infanrix et comprenant 0,5 milligramme (mg) — ou 500 microgrammes (μg) — d’hydroxyde d’aluminium comme adjuvant, la FDA a noté que :
En l’absence d’un corrélat de laboratoire ou sérologique de protection contre la coqueluche, il a été demandé au promoteur de démontrer que les réponses en anticorps aux antigènes coquelucheux chez les enfants américains recevant Infanrix en série primaire de trois doses étaient comparables aux réponses des enfants italiens et allemands immunisés dans les études d’efficacité.
La FDA a souligné une nouvelle fois qu’aucun des tests utilisés pour la mesure des anticorps « n’a montré de corrélation avec la protection » contre la coqueluche. La notice actuelle d’Infanrix (package insert) indique également « qu’un corrélat sérologique de protection contre la coqueluche n’a pas été établi », ce qui signifie qu’il n’existe aucun niveau spécifique d’anticorps dont la corrélation avec la protection immunitaire contre la maladie a été démontrée.
Selon l’agent pathogène et l’individu, avoir un niveau élevé d’anticorps ne signifie pas nécessairement que la personne est protégée contre la maladie, et avoir un faible niveau d’anticorps ne signifie pas nécessairement que la personne n’est pas immunisée. La FDA a néanmoins accepté les mesures du taux d’anticorps comme mesure de substitution de l’immunité (a surrogate measure of immunity) aux fins de l’homologation des vaccins.
3. Absence de groupes témoins placebo et « effets non spécifiques » des vaccins
Pour rassurer le public, le CDC déclare que les adjuvants à base d’aluminium ont été utilisés « en toute sécurité » dans les vaccins depuis plus de 70 ans. Mais cette déclaration est pratiquement dénuée de sens. Ce n’est pas parce que l’aluminium est utilisé comme adjuvant dans les vaccins depuis tant de décennies que ces vaccins n’ont pas provoqué d’effets indésirables chez les enfants. Cette déclaration du CDC pose simplement la question.
Le CDC affirme également qu’il surveille continuellement la sécurité des vaccins après leur homologation par la FDA, mais les données de surveillance post-commercialisation ne remplacent pas les études de sécurité correctement conçues.
Comme le notent les auteurs d’un article (article) publié dans le Journal of Pharmacy and Pharmacology en mars 2015, « l’adjuvant le plus utilisé, l’alun, est utilisé depuis près de 90 ans, mais son mécanisme d’action reste mal compris. De plus, si l’alun produit une puissante réponse anticorps Th2, il ne provoque pas la réponse immunitaire cellulaire nécessaire à l’élimination des infections intracellulaires ou des cancers. »
« L’adjuvant le plus utilisé, l’alun, l’est depuis près de 90 ans, mais son mécanisme d’action reste mal compris. »
Les auteurs de l’étude des CDC établissant un lien entre les vaccins avec adjuvant et l’asthme ont reconnu la possibilité que « l’exposition à l’aluminium par le biais de la vaccination puisse produire un profil immunitaire biaisé vers les cellules Th2 et éloigné des réponses immunitaires des cellules T helper 1 (Th1) ». Cette inclinaison du système immunitaire vers une réponse anticorps au détriment d’une immunité cellulaire déséquilibrée pourrait éventuellement « augmenter le risque de maladies allergiques telles que l’asthme ».
En effet, comme le notent les auteurs d’une critique (review) publiée en 2005 dans l’European Respiratory Journal, « des preuves expérimentales substantielles soutiennent désormais l’idée que les maladies allergiques sont caractérisées par une déviation du système immunitaire vers un phénotype de cellules T auxiliaires de type 2 (Th2). » Comme l’ont observé de manière similaire les auteurs d’une critique intitulée « Immunité des cellules T CD4+ néonatales déséquilibrées (Unbalanced neonatal CD4+ T-cell immunity) et publiée dans Frontiers in Immunology en 2014, le développement de l’asthme est connu pour être associé à « une réponse immunitaire biaisée par les Th2 ».
Les CDC rassurent néanmoins le public en affirmant que tous les vaccins contenant de l’aluminium « sont testés pour leur sécurité et leur efficacité lors d’essais cliniques avant d’être autorisés à être utilisés aux États-Unis ».
Toutefois, cela ne signifie pas que l’innocuité et l’efficacité de ces vaccins ont été testées dans le cadre d’essais randomisés contrôlés par placebo.
Si l’on reprend l’exemple d’Infanrix, le document « Résumé des Motifs d’Approbation de la FDA » révèle qu’aucun placebo inerte n’a été utilisé. Au lieu de cela, la FDA a déterminé que le vaccin DTaP était « sûr » en se basant sur une comparaison des événements indésirables survenus après l’administration de l’ancien vaccin anticoquelucheux à cellules entières (DTP), qui a été retiré du marché aux États-Unis précisément parce qu’il était plus « réactogène » (more « reactogenic »), ce qui a suscité l’inquiétude des parents au sujet des blessures causées aux enfants par le vaccin. (souligné par le traducteur !)
Ce sont en grande partie les procès pour blessures vaccinales intentés aux fabricants du vaccin DTC (NdT : diphtérie, tétanos, coqueluche) qui ont conduit le gouvernement américain à adopter, en 1986, une loi accordant une large immunité juridique aux fabricants contre les procès pour blessures vaccinales et établissant le Programme d’indemnisation des victimes de vaccins (Vaccine Injury Compensation Program—VICP) afin de transférer la charge financière des blessures vaccinales de l’industrie pharmaceutique vers les consommateurs contribuables.
Le vaccin DTC est encore très largement utilisé dans les pays en développement, où des études sur les « effets non spécifiques » des vaccins, terme qui désigne les conséquences involontaires, bénéfiques ou néfastes de la vaccination, ont montré que le vaccin était associé à un taux accru de mortalité infantile. Comme le soulignent les principaux chercheurs dans ce domaine dans une étude publiée en 2017 dans la revue EBioMedicine du Lancet :
« Il faut s’inquiéter du fait que l’effet des vaccinations de routine sur la mortalité toutes causes confondues n’a pas été testé dans des essais randomisés. Toutes les données actuellement disponibles suggèrent que le vaccin DTP pourrait tuer plus d’enfants d’autres causes qu’il n’en sauve de la diphtérie, du tétanos ou de la coqueluche (souligné par le traducteur). Bien qu’un vaccin protège les enfants contre la maladie cible, il peut simultanément augmenter la sensibilité à des infections non liées »
(remarque du traducteur : cette affirmation — que le vaccin protège contre la maladie cible — n’est étayée par aucune étude scientifique).
Cet effet non spécifique préjudiciable s’est avéré vrai pour les vaccins « non vivants » en général (true for “non-live” vaccines generally), qui sont les types de vaccins qui contiennent généralement de l’aluminium comme adjuvant, et l’effet est particulièrement prononcé chez les enfants de sexe féminin. (Les vaccins à virus « vivants » atténués, comme le vaccin contre la rougeole, ne nécessitent pas d’adjuvant pour induire une réponse immunitaire suffisante, car l’exposition à l’antigène du vaccin ressemble davantage à l’exposition au virus viable entier de l’infection naturelle).
« Il est préoccupant de constater que l’effet des vaccinations systématiques sur la mortalité toutes causes confondues n’a pas été testé dans des essais randomisés »
Le document de la FDA relatif à Infanrix décrit curieusement un essai d’efficacité du vaccin DTC comme ayant été « contrôlé par placebo », mais il n’y a aucune mention d’un groupe de contrôle placebo. Au lieu de cela, le « placebo » qui a manifestement été utilisé était le vaccin DTC.
Le problème de l’utilisation courante de substances biologiquement réactives à la place d’un véritable placebo se reflète dans le titre d’une étude publiée dans Annals of Internal Medicine : « Qu’y a-t-il dans les placebos ? Qui sait ? Analyse d’essais contrôlés randomisés » (What’s in Placebos: Who Knows? Analysis of Randomized Controlled Trials). Cette étude soulignait que la plupart des études « ne divulguaient pas la composition du placebo de l’étude » et « qu’aucune réglementation ne régit la composition des placebos, ce qui peut influencer les résultats des études ».
Bien entendu l’utilisation d’un autre vaccin contenant de l’aluminium comme « placebo » pour déterminer la prétendue innocuité d’un autre vaccin contenant de l’aluminium dissimulera le véritable taux de fond d’effets indésirables après la vaccination, ce qui permettra au produit pharmaceutique d’être qualifié « d’inoffensif » par la FDA.
Au lieu d’essais randomisés contrôlés par placebo démontrant l’innocuité à long terme des vaccins contenant de l’aluminium, les chercheurs doivent se fier à des études toxicologiques ou à des études d’observation post-commercialisation.
Cependant, comme l’a reconnu (acknowledged) en 2015 le directeur du Bureau de la sécurité des vaccinations des CDC, Frank DeStefano, « aucune étude épidémiologique de grande envergure n’a examiné spécifiquement les associations entre les problèmes de santé » et les adjuvants à l’aluminium.
D’où le fait que le CDC s’appuie sur l’étude de Mitkus et coll. réalisée par la FDA pour étayer son affirmation sur la prétendue sécurité des vaccins contenant de l’aluminium.
4. La « limite de sécurité » de la FDA pour l’exposition à l’aluminium par rapport au calendrier des vaccins
L’Agence de Protection de l’Environnement (en anglais Environmental Protection Agency ou EPA) a établi un niveau maximal de contamination (maximum contaminant level for aluminum) pour l’aluminium dans l’eau potable de 0,05 à 0,2 milligramme par litre (mg/L), et la propre limite maximale « sûre » de la FDA pour l’eau potable est de 0,2 milligramme par litre, soit 200 microgrammes par litre (µg/L).
En vertu de la réglementation fédérale (federal regulations), pour les médicaments ou thérapies administrés en grande quantité par voie parentérale, c’est-à-dire sans passer par le tube digestif (par exemple par injection intramusculaire ou intraveineuse), la FDA a fixé une limite maximale « sûre » de 25 microgrammes par litre (µg/L).
Ces produits doivent inclure dans leur notice un avertissement indiquant que la teneur en aluminium « peut être toxique » et que « Les recherches indiquent que les patients dont la fonction rénale est altérée, y compris les nouveau-nés prématurés, qui reçoivent par voie parentérale des doses d’aluminium supérieures à 4 à 5 µg/kg/jour accumulent de l’aluminium à des niveaux associés à une toxicité pour le système nerveux central et les os. Une charge tissulaire peut se produire à des taux d’administration encore plus faibles. »
L’Agence pour les Substances Toxiques et le registre des Maladies (en anglais «Agency for Toxic Substances and Disease Registry ou ATSDR»), un département supervisé administrativement par le directeur du CDC et fonctionnant aux côtés du CDC et de la FDA sous les auspices du Department of Health and Human Services (HHS), a également défini un “niveau de risque minimal” (en anglais MRL) pour l’aluminium, qui est ‘une estimation de l’exposition humaine quotidienne à une substance qui est susceptible d’être sans risque appréciable d’effets néfastes (non cancérigène) sur une durée d’exposition spécifiée’.
Le niveau « sûr » pour une « exposition orale chronique (365 jours ou plus) à l’aluminium », selon l’ATSDR, est de 1 mg/kg/jour. C’est ce « niveau de risque minimal » estimé qui a servi de base aux calculs effectués par Mitkus et coll.
Le premier point à souligner concernant la tromperie du CDC est la façon dont il présente cette étude comme ayant examiné « la quantité d’exposition à l’aluminium chez les personnes qui suivent le calendrier vaccinal recommandé », alors qu’en fait l’étude était limitée aux seules doses de vaccin administrées aux nourrissons pendant leur première année de vie. Les enfants qui suivent le calendrier des CDC continuent à recevoir des vaccins contenant de l’aluminium après leur premier anniversaire, de sorte que la déclaration des CDC est trompeuse. Mais c’est la moindre des tromperies des CDC.
En utilisant le calendrier de 2011, Mitkus et coll. ont examiné « les combinaisons potentielles de vaccins infantiles de routine autorisés par la FDA » pour « déterminer les doses maximales d’aluminium qu’un enfant pourrait recevoir au cours d’une année ».
Le premier jour de leur vie, les nourrissons reçoivent généralement 0,25 mg d’aluminium provenant du vaccin contre l’hépatite B (HepB).
À l’âge de deux mois, puis à nouveau à l’âge de quatre mois, ils peuvent recevoir une dose de vaccin contre l’hépatite B, de vaccin DTaP, de vaccin antipoliomyélitique inactivé (VPI), de vaccin contre l’Haemophilus influenzae de type B (Hib) et de vaccin antipneumococcique (VPC), ce qui, selon les marques choisies, peut entraîner une exposition à 1,2 mg d’aluminium à chacune de ces deux visites chez le médecin.
À l’âge de six mois, les enfants pourraient recevoir le HepB (Hépatite B), le DTaP (Diphtérie, tétanos, coqueluche acellulaire) l’IPV (Polio inactivé) et le PCV (Pneumocoque), ce qui entraînerait une exposition à l’aluminium pouvant atteindre 0,975 mg.
Lors de leur visite médicale d’un an, les enfants pourraient recevoir le Hib (Haemophilus influenza type b), le PCV et le vaccin HepA (Hépatite A), ce qui représente une exposition à l’aluminium de 0,6 mg.
L’étude fournit le tableau suivant résumant la quantité maximale d’aluminium à laquelle les nourrissons étaient exposés au cours de leur première année de vie selon le calendrier vaccinal du CDC en 2011 :
Tableau 1
Séquence d’administration des vaccins conduisant à une exposition maximale à l’aluminium chez les nourrissons au cours de leur première année de vie. Basé sur le calendrier de vaccination de l’ACIP (Advisory Committee on Immunization Practices—Comité consultatif sur les pratiques d’immunisation).
| Vaccin | Âge de l’enfant (jours) | Teneur en aluminium |
|---|---|---|
| Hep B | 0 | 0,25 |
| DTaP + Hep B + IPV +Hib + PCV | 60 | 1,2 |
| DTaP + Hep B + IPV + Hib + PCV | 120 | 1,2 |
| DTaP + Hep B + IPV + PCV | 180 | 0,975 |
| Hib + PCV + Hep A | 365 | 0,6 |
La FDA et les CDC nous assurent que cette exposition cumulée à l’aluminium que les enfants suivant le calendrier pourraient recevoir au cours de leur première année de vie — jusqu’à 4 225 microgrammes — représente une « faible » quantité d’aluminium qui est totalement « sans danger ». Cependant, comme l’indique un examen des preuves disponibles sur les adjuvants de l’aluminium et l’autisme publié dans le Journal of Trace Elements in Medicine and Biology en avril 2021 (a review), cette étude « était sérieusement défectueuse ». Nous allons maintenant examiner en détail les principales erreurs de l’étude pour illustrer comment l’allégation de sécurité du gouvernement est scientifiquement frauduleuse.
5. Le « niveau de risque minimal » falsifié de la FDA pour l’aluminium
Comme on l’a vu, la conclusion des chercheurs de la FDA selon laquelle la quantité d’aluminium à laquelle les enfants sont exposés par les vaccins administrés au cours de la première année de vie présente un « risque extrêmement faible pour les nourrissons » était fondée sur un « niveau de risque minimal » fixé par l’ATSDR à 1 mg/kg/jour, et les expositions inférieures à ce niveau sont considérées comme « sûres » par la FDA.
En utilisant cette limite « sûre », les chercheurs de la FDA ont calculé la « charge corporelle » d’aluminium provenant des adjuvants à base de phosphate d’aluminium (AlPO4) ou d’hydroxyde d’aluminium (Al [OH] 3). Les deux graphiques qu’ils présentent suggèrent que les niveaux cumulatifs d’aluminium auxquels les enfants sont exposés par le calendrier vaccinal sont bien inférieurs à la limite « sûre » de la FDA.

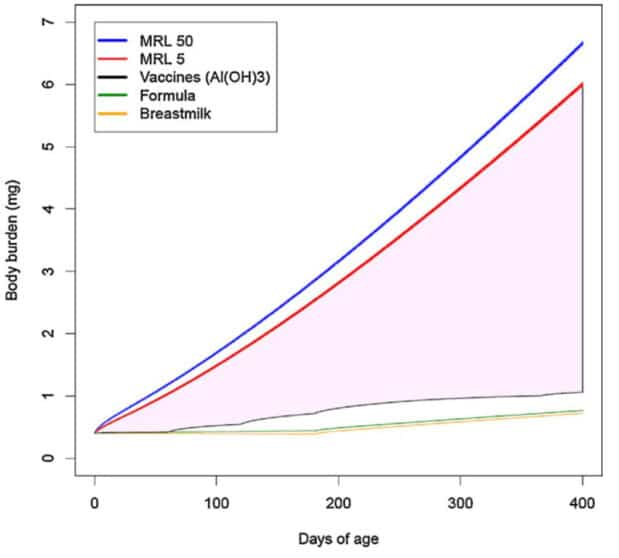
Cependant, le CDC omet d’informer le public que le niveau de risque minimal utilisé par les chercheurs de la FDA a été calculé sur la base d’une seule étude portant sur l’ingestion de lactate d’aluminium, une forme soluble d’aluminium, chez des souris adultes. (souligné par le traducteur !)
Les problèmes majeurs de l’étude de la FDA ont été observés dans une critique rédigée anonymement, publiée sur le site Vaccine Papers en juillet 2016 et intitulée « Démystifier l’adjuvant aluminium, 2e partie : l’étude erronée de la FDA sur la toxicité de l’adjuvant aluminium » (Debunking Aluminum Adjuvant, Part 2: FDA’s Flawed Study of Al Adjuvant Toxicity (Mitkus 2011)). Comme indiqué dans cet article, le niveau de risque minimal utilisé par les chercheurs de la FDA « est basé sur une science obsolète et erronée. » Elle a été « dérivée d’une “dose sans effet indésirable observé” (NOAEL) mesurée dans une étude d’alimentation animale ». L’article explique :
Cependant, il y a un problème fatal : 26 mg/kg/jour n’est pas un NOAEL (dose sûre) pour les animaux ((NOAEL pour No Observed Adverse Effect Level—Niveau sans effet indésirable observé). La NOAEL de 26 mg/kg/jour (ingéré) est le fondement de l’analyse de Mitkus, et elle est erronée. Les études scientifiques font état d’effets indésirables (par exemple, lésions cérébrales, troubles cognitifs et inflammation du cerveau) dus à des doses d’aluminium ingéré (et hydrosoluble) de 3,4, 4, 5,6, 6, 10 et 20 mg/kg/jour.
Ces études sont examinées dans un article distinct sur Vaccine Papers intitulé « Le fondement de la sécurité des adjuvants est faux » (The Foundation for Al Adjuvant Safety Is False).
Dans un article publié dans le Journal des Médecins et Chirurgiens Américains en 2016, Neil Z. Miller, auteur du livre Miller’s Review of Critical Vaccine Studies (Révision par Miller des études critiques sur les vaccins), explique de la même manière plusieurs « défauts majeurs dans l’analyse de la FDA », à commencer par l’utilisation d’un niveau de risque minimal qui avait déjà été falsifié par d’autres études animales (c’est nous qui soulignons) :
Pour déterminer un « niveau de risque minimal » (LMR pour limite minimale de risque) d’aluminium pour les humains, une seule étude animale a été utilisée. Cette étude a révélé que les souris pouvaient recevoir jusqu’à 26 milligrammes d’aluminium par kilogramme de poids corporel par jour (26 mg/kg/jour) sans effets indésirables. Après avoir pris en compte les différences entre les souris et les humains (et d’autres facteurs), ce chiffre a été réduit pour créer une marge de sécurité, et une LMR de 1 mg/kg/jour a été établie pour les humains, y compris les nourrissons. Mais il y a un problème : 26 mg/kg/jour n’est pas une quantité d’aluminium sûre pour les animaux. Plusieurs études confirment que des quantités d’aluminium beaucoup plus faibles (de 3,4 à 6,1 mg/kg/jour) sont nocives pour les animaux — et au moins trois de ces études ont été publiées avant le document de la FDA en 2011, de sorte que l’étude de la FDA était fallacieuse dès le départ.
Dans une révision intitulée « Critical analysis of reference studies on the toxicokinetics of aluminum-based adjuvants » (Analyse critique des études de référence sur la toxicocinétique des adjuvants à base d’aluminium), publiée dans le Journal of Inorganic Biochemistry en décembre 2017, Jean-Daniel Masson et coll. expliquent de la même manière que l’étude de Mitkus souffre de plusieurs biais importants. « Le premier problème est qu’« Une LMR orale inappropriée a été utilisée pour définir la courbe de sécurité. » La « LMR orale » utilisée par les chercheurs de la FDA « fixe la courbe de sécurité trop haut ». Citant des études constatant des effets indésirables chez les animaux à des niveaux d’exposition beaucoup plus faibles, notamment une étude de 2017 observant des effets indésirables avec une exposition de 1,5 mg/kg/jour, les auteurs de l’examen font remarquer :
En utilisant la LMR orale « officielle », Mitkus a donc fixé la courbe de sécurité à un niveau beaucoup plus élevé. Ce niveau a été surestimé d’un facteur allant jusqu’à 17,3 (c’est-à-dire 26/1,5) lorsque l’étude la plus récente a été prise en compte. Il convient de noter que la dose de 1,5 mg/kg/jour n’est même pas une NOAEL puisque des effets ont été documentés à cette dose.
Les auteurs de la révision présentent deux graphiques corrigés, publiés à l’origine par l’auteur de l’article Vaccine Papers, qui montrent comment, « même si l’on utilise des niveaux NOAEL expérimentaux plus élevés pour le calcul, par exemple 3,4 mg/kg/d, la limite de sécurité est atteinte (hydroxyde) ou dépassée (phosphate) par l’aluminium des adjuvants vaccinaux ».


6. Aluminium injecté comparé à l’aluminium ingéré
Il y a pire. Comme indiqué, le niveau de risque minimal utilisé par les chercheurs de la FDA comme base de leurs calculs est issu d’une étude sur l’aluminium ingéré et non injecté.
Comme la FDA le sait parfaitement (the FDA knows perfectly well), « le tractus gastro-intestinal agit comme une barrière efficace à l’absorption de l’aluminium, et relativement peu d’aluminium ingéré atteint effectivement les tissus du corps », alors que « les produits pharmaceutiques administrés par voie parentérale contenant de l’aluminium contournent le mécanisme de protection du tractus gastro-intestinal » et se « déposent dans les tissus humains ».
Mitkus et coll. ont reconnu de la même façon (c’est nous qui soulignons) :
Les expositions potentielles à l’aluminium associées à l’administration de vaccins sont toutefois différentes des expositions alimentaires à l’aluminium, car l’aluminium contenu dans les vaccins n’a pas à traverser les parois du tractus gastro-intestinal, qui constitue une barrière importante à l’absorption systématique de l’aluminium. On s’attend plutôt à ce que la totalité de l’aluminium contenu dans l’adjuvant soit absorbée des muscles dans le sang après la vaccination, bien qu’à un certain taux au fil du temps.
… L’exposition à l’aluminium par voie alimentaire (généralement sous forme de citrate) entraîne l’absorption de petites quantités d’aluminium à partir de l’intestin (inférieur à 1 %) avant d’atteindre la circulation sanguine.
Pourtant, ils n’ont curieusement fait aucun commentaire sur la façon dont le niveau d’exposition « sûr » qu’ils ont adopté comme base de leur analyse était basé sur l’aluminium ingéré par les rongeurs, ce qui pourrait raisonnablement être interprété comme une indication de l’intention de commettre une fraude scientifique.
Comme le commente Miller :
La LMR pour les humains est dérivée de l’aluminium alimentaire donné à des souris. Mais les nourrissons reçoivent de l’aluminium par injection. L’aluminium injecté contourne le tractus gastro-intestinal et possède des propriétés toxiques uniques par rapport à l’aluminium ingéré. Pour déterminer la sécurité de l’aluminium injecté, les scientifiques doivent mener des expériences avec de l’aluminium injecté et non ingéré.
7. Ignorer la toxicité des particules d’aluminium
Ce qui explique peut-être l’incapacité des auteurs à reconnaître l’inapplicabilité de l’étude sur les rongeurs adultes utilisée pour déterminer le « niveau de risque minimal » adopté pour les nourrissons humains, c’est le fait qu’ils n’ont considéré que la quantité d’aluminium qui se dissout et est absorbée dans le sang, d’où il peut ensuite être traité par les reins et excrété dans l’urine, comme contribuant à la « charge corporelle » de la toxicité de l’aluminium ; ils ont complètement ignoré la quantité d’aluminium particulaire qui reste dans les tissus et les organes.
Il s’agit là d’une « erreur critique », comme l’a noté l’auteur de l’article de Vaccine Papers :
L’analyse de Mitkus est un moyen raisonnable d’estimer la toxicité et la rétention de l’aluminium hydrosoluble ingéré (ions Al3+). Mais elle ne peut pas établir la sécurité des particules d’aluminium adjuvantes persistantes et peu solubles…
La LMR est dérivée d’une expérience d’alimentation avec du lactate d’aluminium hydrosoluble, et non des particules d’adjuvant d’aluminium insolubles et persistantes. La sécurité de l’adjuvant d’aluminium injecté ne peut être prouvée que par des expériences avec l’adjuvant d’aluminium injecté (qui comprend des particules insolubles et persistantes). Les études sur l’aluminium ingéré, soluble dans l’eau, ne sont pas un bon substitut. Les études scientifiques ont établi que l’adjuvant d’aluminium injecté a des propriétés toxiques uniques et des façons de se déplacer dans le corps (« cinétique ») qui ne sont pas les mêmes que celles de l’aluminium hydrosoluble. (NdT : cinétique = fonction du temps)
L’erreur consistant à utiliser une étude sur l’ingestion d’une forme soluble d’aluminium est aggravée par le « défaut fatal » supplémentaire consistant à ignorer la toxicité des particules d’aluminium restant dans l’organisme :
Mitkus suppose que l’adjuvant d’aluminium a une toxicité nulle lorsqu’il est sous forme de particules. La « charge corporelle » de Mitkus ne comprend pas les particules d’adjuvant d’aluminium. Dans l’analyse de Mitkus, seuls les ions Al3+ (libérés par la dissolution des particules d’adjuvant) sont toxiques.
C’est pourquoi la courbe de l’adjuvant Al présente une pente ascendante après chaque date de vaccination… Les nanoparticules d’adjuvant Al ne sont pas inoffensives ou inertes. Elles sont biologiquement actives et provoquent une inflammation et une activation du système immunitaire. C’est pourquoi l’adjuvant aluminium est utilisé dans la plupart des vaccins. Les particules d’adjuvant se déplacent vers les tissus qui peuvent être blessés par l’inflammation, comme, par exemple, le cerveau.
L’article présente cette illustration graphique des défauts fatals de l’étude de la FDA ainsi que le commentaire suivant : (titre du schéma : Les hypothèses fatalement erronées de Mitkus)
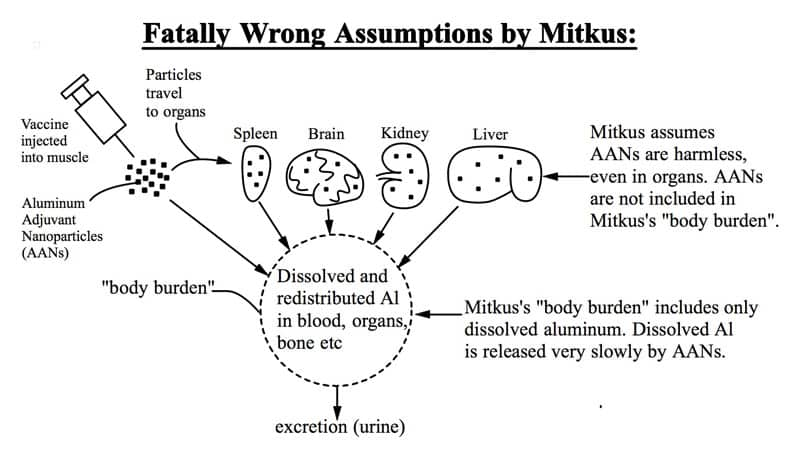
Ci-dessus : Les nanoparticules d’adjuvant Al injectées voyagent vers des organes distants (rate, cerveau, reins, foie) où elles restent pendant des années, provoquant des inflammations. Mitkus suppose que les particules n’ont aucune toxicité, même lorsqu’elles sont présentes dans des organes sensibles comme le cerveau. Mitkus suppose à tort que seul l’Al3+ dissous est toxique. Il n’existe aucune preuve de cette hypothèse, et les expériences sur les animaux et les études sur la toxicité des autres nanoparticules montrent de manière concluante que celle-ci est fausse (l’hypothèse de Mitkus).
Neil Z. Miller observe de même que « les nanoparticules d’aluminium peuvent être transportées par les cellules à lignage monocytaire vers les ganglions lymphatiques de drainage, le sang et la rate et peuvent également pénétrer dans le cerveau. » Néanmoins, la FDA « suppose, sans preuve, que ces nanoparticules d’aluminium faiblement biodégradables, qui ont été détectées dans les organes du corps jusqu’à un an après la vaccination, sont inoffensives, et elles ne sont pas calculées par la FDA comme faisant partie de la « charge corporelle » d’aluminium jusqu’à ce qu’elles se dissolvent. »
Masson et coll. critiquent également Mitkus et coll. pour ne pas avoir pris en compte la toxicité de l’aluminium particulaire, en faisant remarquer (c’est nous qui soulignons) :
Sous sa forme particulaire, l’aluminium est rapidement capturé puis transporté à distance par les cellules immunitaires. La comparaison entre la toxicité chimique des ions Al3+, tels que ceux absorbés au niveau intestinal, et la toxicité particulaire des sels d’aluminium injectés (par voie intramusculaire) est donc un non-sens. En témoigne la courbe dose-réponse atypique des effets neurotoxiques de l’hydroxyde d’aluminium, avec un transfert cérébral de l’aluminium et un effet clinique observé sélectivement pour les faibles doses, qui se rapproche de celles décrites en toxicologie particulaire. En toute rigueur, les LMR utilisées pour la modélisation du risque vaccinal devraient être définies sur la base d’expérimentations animales réalisées avec des adjuvants d’aluminium, contrôlées pour que leurs paramètres particulaires soient conformes à ceux des vaccins, et injectés (par voie intramusculaire), plutôt que des études avec des formes solubles d’aluminium (chlorure ou lactate) ajoutées à la nourriture ou à l’eau de boisson.
En mentionnant « la courbe dose-réponse atypique des effets neurotoxiques de l’hydroxyde d’aluminium », ils faisaient référence à une étude de Guillemette Crépeaux et coll. intitulée « Non-linear dose-response of aluminium hydroxide adjuvant particles: Selective low dose neurotoxicity » (Réponse dose non linéaire des particules adjuvantes d’hydroxyde d’aluminium : Neurotoxicité sélective à faible dose), qui a été publiée dans la revue Toxicology en 2017.
Comme l’ont noté les auteurs de cette étude de Toxicology, des expériences sur des souris avaient montré « la capture et le transport lent » de particules d’aluminium « par des cellules à lignage monocytaire depuis le muscle injecté vers les organes lymphoïdes et finalement le cerveau. » Leurs conclusions indiquaient que l’adjuvant d’aluminium « injecté à faible dose dans le muscle de la souris peut induire sélectivement une accumulation cérébrale (d’aluminium) à long terme et des effets neurotoxiques. »
Les auteurs ont souligné de façon peu convaincante que « la comparaison de l’exposition à l’adjuvant vaccinal à d’autres expositions à l’aluminium non pertinentes, par exemple l’aluminium soluble et d’autres voies d’exposition, peut ne pas représenter des approches valables. »
À titre d’exemple, ils ont cité Mitkus et coll., dont le modèle de rétention des nourrissons était basé sur « le taux de rétention de l’aluminium observé après des injections intraveineuses de citrate d’aluminium soluble traçable ». Le modèle de la FDA était « basé sur l’hypothèse que les adjuvants d’aluminium sont solubilisés par les ions citrate dans le liquide interstitiel des muscles, sans aucune considération de l’absorption cellulaire rapide de l’adjuvant et de la diffusion systémique à long terme des agglomérats d’adjuvants. » (C’est nous qui soulignons.) Ils ont conclu en suggérant, encore une fois de façon peu convaincante, qu’une « réévaluation » de la sécurité des adjuvants à base d’aluminium est nécessaire.
Pour en revenir à la critique de l’étude de la FDA par Masson et coll., ils ont noté que le modèle mathématique développé par Mitkus et coll. incorporait également une estimation de la rétention d’aluminium chez les enfants basée sur une étude d’un seul adulte ayant reçu une injection intraveineuse de citrate d’aluminium, une forme soluble d’aluminium.
Mitkus et coll. ont souligné que « l’on s’attend à ce que l’aluminium ne soit pas éliminé du sang des nourrissons aussi rapidement que celui des adultes », et ils ont donc tenté d’ajuster leur modèle pour tenir compte de la rétention plus élevée chez les nourrissons.
« La comparaison entre la toxicité chimique des ions Al3+, tels que ceux absorbés au niveau intestinal, et la toxicité particulaire des sels d’aluminium injectés (par voie intramusculaire) n’a donc aucun sens. »
Cependant, comme Mitkus et coll. le reconnaissent également, « Pour les vaccins, l’injection est intramusculaire, l’aluminium est sous une forme insoluble (par exemple, sous forme de phosphate ou d’hydroxyde d’aluminium), et le muscle au site d’injection est considéré comme un dépôt de stockage pour l’aluminium ». Ils reconnaissent que l’une des limites de leur étude est que leur « fonction de rétention » pour l’aluminium est « basée sur les résultats d’une seule personne », alors qu’idéalement elle devrait être basée sur des données pharmacocinétiques chez plusieurs nourrissons.
Pour estimer leur taux d’absorption d’aluminium, qui représente les particules d’aluminium qui « sont solubilisées par les ions citrate dans les fluides interstitiels du muscle » et absorbées dans le sang, ils ont utilisé les données d’une étude portant sur l’absorption d’aluminium administré par voie intramusculaire à deux lapins pour chacun des deux types d’adjuvant d’aluminium utilisés dans les vaccins pour enfants (hydroxyde d’aluminium et phosphate d’aluminium).
Ils ont reconnu les limites de leur étude, mais ils ont insisté sur le fait qu’il y a une « libération lente de l’adjuvant aluminium du site d’injection dans la circulation systémique ». Puisqu’ils ont supposé que seule la quantité d’aluminium absorbée dans le sang contribuait à la charge corporelle de la toxicité de l’aluminium, ils ont interprété ce résultat comme étant rassurant.
Par exemple, ils notent que si 100 % de l’aluminium injecté était instantanément absorbé dans le sang (ce qui serait également le cas pour une injection intraveineuse par opposition à une injection intramusculaire), il y aurait alors « de brèves ”excursions” des niveaux d’aluminium corporels au-dessus de la LMR après la vaccination ». Ils ont raisonné que puisque l’absorption de l’aluminium dans le sang se fait lentement plutôt qu’instantanément, le risque de toxicité est plus faible.
Cependant, ce raisonnement est à nouveau fallacieux puisque l’hypothèse selon laquelle la quantité d’aluminium particulaire restant dans le corps n’est pas toxique est fausse.
Masson et coll. commentent également cet aspect de l’étude de la FDA :
Mitkus et coll. ont tenu compte de la lenteur de l’absorption (solubilisation) de l’aluminium des adjuvants démontrée par Flarend et, ce faisant, ont trouvé une marge de sécurité apparemment élevée. Pour construire leur modèle, Mitkus et coll. ont raisonné comme suit : puisque l’absorption sanguine de l’aluminium était de 51 % pour l’adjuvant phosphate 28 jours après les injections dans l’étude de Flarend, il faudrait 28 jours de plus pour absorber la totalité de la dose d’adjuvant injectée (56 jours au total). De même, étant donné que l’absorption sanguine de l’aluminium était de 17 % pour l’hydroxyde d’aluminium à 28 jours, l’absorption complète prendrait 137 jours supplémentaires (total 165 jours). La quantité cumulée calculée d’aluminium absorbé par les vaccins était significativement plus élevée que l’absorption d’aluminium alimentaire… mais restait inférieure au niveau de sécurité pour le phosphate d’aluminium, et très largement inférieure pour l’hydroxyde d’aluminium. La conclusion de l’auteur est qu’il est peu probable que l’aluminium des vaccins ait une influence significative sur la charge corporelle en aluminium de l’organisme du nourrisson, ce qui implique une bonne sécurité des adjuvants à l’aluminium de 0 à 12 mois.
Cependant, l’étude de la FDA « souffre d’un certain nombre de biais importants ». Comme nous l’avons déjà noté, les chercheurs de la FDA ont utilisé un niveau de risque minimal inapproprié qui avait déjà été falsifié par d’autres études montrant des effets indésirables chez les animaux à des niveaux d’exposition beaucoup plus faibles. Ils ont également ignoré la toxicité des particules d’aluminium qui restent dans le corps plutôt que d’être absorbées dans le sang. De plus, ils ont incorporé dans leur modèle une interprétation erronée de l’étude sur les lapins réalisée par Flarend et coll. (c’est nous qui soulignons) :
Comme Flarend avant lui, Mitkus et coll. n’ont apparemment considéré que seul aluminium soluble a un potentiel toxique. Son estimation de la durée de la translocation complète de l’aluminium du site injecté vers le sang est basée sur un calcul simpliste (voir ci-dessus) qui ne tient pas compte du fait que les courbes de Flarend suggèrent que la fin de la translocation de l’Al vers le plasma est soit en cours (phosphate) soit presque achevée (hydroxyde) au 28e jour (voir ci-dessus). Le corollaire de ce calcul trop simpliste est une sous-estimation du temps de biopersistance de l’aluminium sous une forme particulière. Des études histologiques réalisées après l’injection (intramusculaire) d’hydroxyde d’aluminium ont montré que l’aluminium particulaire et les granulomes qu’il induit sont encore détectables dans le muscle injecté après des mois dans les études animales et plusieurs années (jusqu’à 12 ans) chez les patients adultes atteints du syndrome de fatigue chronique post-vaccinale. Bien que des facteurs génétiques puissent expliquer la faible solubilisation intracellulaire de l’hydroxyde d’aluminium chez les individus sensibles, la sous-estimation par Mitkus de la stabilité à la dissolution des adjuvants d’aluminium est certaine et significative.
L’aluminium des vaccins ne reste pas non plus au site d’injection, mais « peut migrer loin du muscle sous sa forme particulaire ».
Selon l’étude de la FDA, il est « rassurant » de constater que « le dépôt de stockage à long terme » de l’aluminium solubilisé à partir du site d’injection se trouve probablement principalement dans les os et non dans des organes comme le cerveau. En ce qui concerne ce raisonnement, Masson et coll. font également le commentaire suivant (c’est nous qui soulignons) :
En ne considérant que l’aluminium soluble, Mitkus pensait que « le dépôt de stockage à long terme (de l’aluminium solubilisé à partir du site d’injection), est susceptible d’être squelettique et non un système d’organes mous plus sensible est rassurant ». Cette hypothèse rassurante ne prenait pas en compte le devenir de l’aluminium particulaire. De même, une étude récente réalisée chez des prématurés vaccinés à l’âge de 2 mois, ne s’est intéressée qu’à l’aluminium soluble détectable dans les fluides corporels : les auteurs ont curieusement jugé « rassurant » le fait de ne pas avoir constaté d’élévation de l’aluminium dans le sérum et l’urine 24 h après l’administration de vaccins contenant une dose totale de 1200 μg Al (environ 200 μg/kg). L’absence à la fois d’absorption détectable et d’élimination rapide de l’aluminium des adjuvants représente plutôt un motif légitime d’inquiétude, car, en corollaire, elle indique probablement la persistance systémique de particules d’aluminium immunostimulantes et neurotoxiques transférées vers les organes lymphoïdes et atteignant potentiellement le cerveau.
Une étude (study) de Grant McFarland et coll. publiée dans le Journal of Trace Elements in Medicine and Biology en décembre 2019 critique de la même manière l’étude de Mitkus et coll. en la décrivant comme ayant été « minutieusement excoriée comme un simple parcours mathématique basé sur l’hypothèse erronée que des doses orales d’aluminium (d’une forme différente de celles trouvées dans les vaccins) chez des souris adultes pourraient être utilisées pour prédire l’impact des vaccins avec adjuvant, comme si ces données pouvaient être transformées via les mathématiques en données pertinentes pour les formes injectées chez les adultes et les enfants humains ».
Comme le résument McFarland et coll. (c’est nous qui soulignons) :
En bref, l’article de Mitkus fonde une évaluation de l’innocuité des formes d’aluminium injectées non solubles dans l’eau chez les adultes humains sur une seule étude des formes d’aluminium hydrosolubles alimentaires chez les souris adultes. Cette étude, choisie parmi de nombreuses autres par l’ATSDR (Agency for Toxic Substances and Disease Registry—Agence pour les Substances Toxiques et le Registre des Maladies), a été utilisée pour affirmer que les doses d’aluminium utilisées sur les humains sont sûres… Les études qui utilisent l’administration orale d’aluminium en solution de citrate… ne sont pas pertinentes pour l’étude de la toxicité des types d’aluminium provenant des vaccins… Les études sur les animaux sont encore plus limitées en raison de leur incapacité à traiter l’hypothèse d’une variation génétique dans la tolérance à l’aluminium chez les humains.
En ce qui concerne la façon dont les chercheurs de la FDA ont cité l’étude sur les lapins comme offrant une réassurance de la sécurité des adjuvants à base d’aluminium dans les vaccins, Masson et coll. font un commentaire similaire (c’est nous qui soulignons) :
Plutôt que de parler de la nature rassurante de ces résultats, une conclusion inverse aurait dû être faite par les auteurs du point de vue de la sécurité des vaccins, soulignant la faible élimination par dissolution des adjuvants aluminiques, en particulier l’adjuvant à base d’hydroxyde, et la nécessité d’autres études à long terme sur un plus grand nombre d’animaux. Les agences de réglementation elles-mêmes auraient été bien avisées de commander des études toxicocinétiques complémentaires afin d’éviter la propagation d’informations hasardeuses sur l’élimination rapide des adjuvants aluminiques, surtout après avoir pris connaissance d’études ultérieures montrant la phagocytose, la persistance intracellulaire, la migration à distance et la neurotoxicité des adjuvants aluminiques.
8. Conclusion
Maintenant, revoyez comment le CDC cite l’étude de Mitkus et coll. de la FDA comme ayant « démontré » que l’aluminium des vaccins « n’est pas facilement absorbé par le corps ». La conclusion logique inéluctable est que cette affirmation de l’établissement de « santé publique » est une dangereuse désinformation.
Le CDC affirme que l’aluminium contenu dans les vaccins a pour but de les aider à « mieux fonctionner », mais ce que cela signifie en réalité, c’est qu’il permet aux fabricants d’atteindre le niveau d’anticorps circulants requis pour obtenir l’autorisation de la FDA, que ce niveau d’anticorps soit ou non en corrélation avec la protection immunitaire contre la maladie. (souligné par le traducteur)
Le CDC affirme que l’aluminium est utilisé dans les vaccins depuis plus de 70 ans, mais cela ne veut certainement pas dire que les niveaux cumulatifs d’aluminium auxquels les enfants sont exposés aujourd’hui selon le calendrier recommandé par les CDC sont « sûrs ».
Le CDC affirme que chaque vaccin avec adjuvant fait l’objet d’essais cliniques avant d’être homologué, mais la FDA autorise les fabricants de vaccins à renoncer aux essais randomisés contrôlés par placebo en faveur d’une comparaison des taux d’effets indésirables entre les personnes recevant le vaccin expérimental et un autre produit contenant de l’aluminium.
Le CDC affirme que les agences gouvernementales contrôlent les données de surveillance post-commercialisation pour garantir la sécurité des vaccins, mais ces données ne remplacent pas les essais randomisés contrôlés par placebo, et ces agences gouvernementales n’ont tout simplement aucune crédibilité étant donné leur conflit d’intérêts inhérent et leur habitude de déformer la science pour l’adapter à leurs objectifs politiques.
Le Dr Frank DeStefano, auteur principal de la récente étude du CDC admettant une association entre les vaccins avec adjuvant et l’asthme, avait reconnu en 2015 l’absence d’études d’observation examinant spécifiquement les associations entre les problèmes de santé et les vaccins contenant de l’aluminium.
Le CDC affirme que « la quantité d’aluminium à laquelle sont exposées les personnes qui suivent le calendrier vaccinal recommandé est faible et n’est pas facilement absorbée par l’organisme », mais cette affirmation est fondée sur une étude de modélisation de la FDA entachée d’erreurs fatales, qui a basé sa conclusion sur un « niveau de risque minimal » déjà falsifié pour l’exposition à l’aluminium et sur l’ignorance délibérée de la FDA de la toxicité de l’aluminium particulaire des vaccins qui reste dans les tissus et les organes au lieu d’être dissous et absorbé dans le sang, où il peut ensuite être traité par les reins et excrété dans l’urine.
À titre de simple expérience de pensée, imaginez quelle serait la réaction de l’establishment de la « santé publique » et des médias grand public si les résultats d’une telle étude soutenaient au contraire la conclusion selon laquelle la quantité d’aluminium à laquelle les enfants sont exposés par les vaccins provoque des dommages. D’une manière ou d’une autre, chaque étude suggérant que les vaccins peuvent causer des dommages est fatalement erronée, tandis que chaque étude dont les résultats peuvent être interprétés — ou mal interprétés — comme soutenant la politique gouvernementale en matière de vaccins est acceptée sans discussion comme une preuve supplémentaire de la « sécurité » des vaccins, sans tenir compte des limitations méthodologiques ou des énormes disparités entre les conclusions des auteurs et leurs résultats réels.
En résumé, l’affirmation du CDC selon laquelle l’aluminium contenu dans les vaccins s’est avéré « sûr », y compris pour les nourrissons, est un mensonge éhonté et montre à quel point le gouvernement est prêt à commettre une fraude scientifique pour soutenir ses politiques de recommandations actuelles. Le fait que le CDC déforme aussi grossièrement l’état des connaissances scientifiques sur la toxicité de l’aluminium est une illustration claire de son manque de fiabilité. Il est clair que le gouvernement est plus soucieux de servir les intérêts financiers de l’industrie pharmaceutique que de la santé publique.
Traduction Jean Bitterlin 18.12.2022
⚠ Les points de vue exprimés dans l’article ne sont pas nécessairement partagés par les (autres) auteurs et contributeurs du site Nouveau Monde.